2025-12-29
基因疗法已成为治疗多种遗传性和获得性疾病的有力工具,而腺相关病毒(AAV)载体已成为此类疗法的首选载体。由于其能够转导神经元、免疫原性相对较低以及具有长期表达的潜力,重组AAV已被用于治疗多种神经系统疾病,包括许多不同类型的中枢神经系统(CNS)疾病。AAV可用于递送内源性治疗蛋白,例如用于蛋白质替代疗法的蛋白,该疗法用功能性拷贝替换缺失或功能异常的蛋白;或非内源性治疗蛋白,例如用于基因组编辑和/或永久性纠正不需要的基因突变的蛋白。后者的一个例子是成簇的规律间隔的短回文重复序列相关(CRISPR-Cas)蛋白。尽管基因疗法具有巨大的潜力,但任何基因治疗方法都需要仔细考虑其局限性,尤其是在外源性CRISPR组分的安全性和精确递送方面。在最近一期的《分子治疗方法和临床开发(Molecular Therapy Methods and Clinical Development)》杂志中,Duba-Kiss和Hampson分享了关于这些局限性的一些宝贵见解,提供了有关使用小鼠模型在CNS中通过AAV介导递送Cas9的免疫学(包括神经炎症)和表达水平的信息。
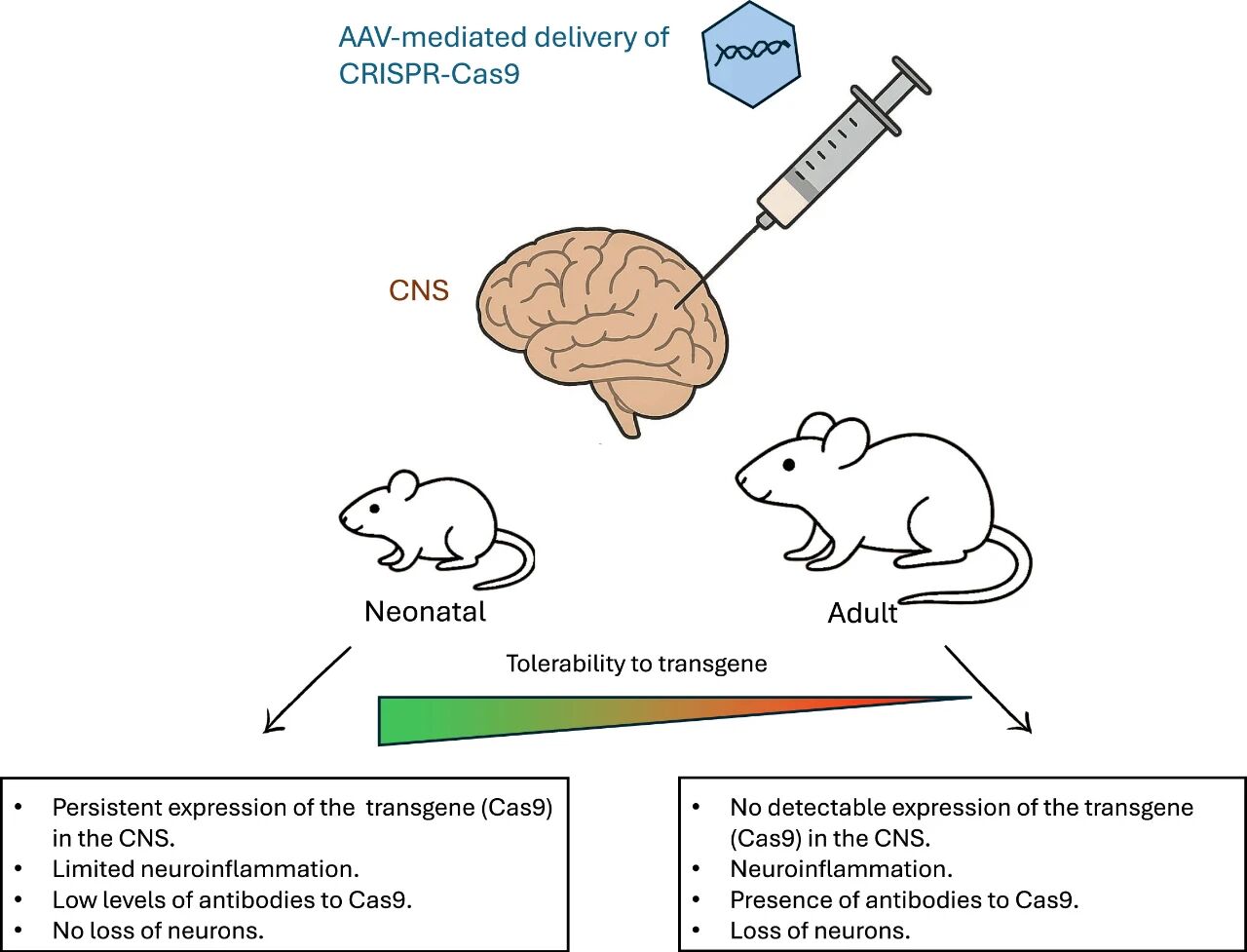
该研究探讨了新生小鼠和成年小鼠脑内经AAV递送的Cas9诱导的免疫反应和神经毒性,结果表明,早期产后给药可以减轻免疫反应。在新生小鼠中,Cas9表达耐受性良好,即使在3个月后仍能持续表达,且神经炎症反应极小。该研究采用的AAV剂量低于静脉注射,并直接注射到脑内。相比之下,成年小鼠注射AAV-Cas9会导致显著的神经元丢失,并伴有小胶质细胞和星形胶质细胞活化以及T细胞和抗体免疫反应,这些反应可能导致表达Cas9的细胞被清除(见下图)。这些发现强调了生命不同阶段神经炎症反应的差异,有助于我们理解CNS如何处理外源蛋白的表达。此外,该研究还强调,在出生后尽早进行基因治疗干预对于通过基因编辑成功治疗大多数神经系统疾病至关重要。
(图片来源:Liebscher Vidal and Martinez-Navio, Mol Ther Methods Clin Dev., 2025)
劲帆生物医药科技(武汉)有限公司简称“劲帆医药”,创立于2022年,提供一站式病毒载体、蛋白和疫苗CRO/CDMO服务,拥有全球领先的规模化AAV制备专利技术平台及病毒载体/cGMP级蛋白/疫苗生产车间,致力于推进基因治疗药物、蛋白药物、治疗性疫苗更有效,更安全,更经济,更可及,赋能客户,造福患者。劲帆医药cGMP生产车间,包括4个P2级别种子建库区、5条蛋白/病毒生产线和1条灌装生产线,蛋白/病毒生产线生产规模分别为200L和500L,年最大产能可达50批次,目前已完成多项项目交付。
越来越多的证据表明,与成人不同,新生儿由于免疫系统尚未发育成熟,更容易对转基因产物产生耐受性而非免疫力。例如,在I型粘多糖贮积症犬模型中,研究人员发现,新生幼犬在体内通过AAV介导系统性递送α-L-艾杜糖醛酸酶(IDUA)后,产生了耐受性。研究人员未检测到针对IDUA酶的抗体;一个月后在CNS(鞘内)再次注射载体,结果显示IDUA表达显著增强,从而发挥了有效的治疗作用并消退了脑部病变。在同一份报告中,研究人员发现,在恒河猴出生时系统性注射AAV后,即使在一个月后再次鞘内注射AAV,也观察到了对转基因产物(IDUA)的耐受性。与此相符,一项近期研究表明,新生猴单次肌注AAV后,体内持续表达强效且广谱的中和性抗HIV抗体超过3年,从而有效预防了猴-人免疫缺陷病毒(HSIV)感染。该研究还表明,新生恒河猴体内AAV介导的抗体表达水平高于较大婴儿和幼猴,提示抗体表达水平与年龄相关。Duba -Kiss和Hampson以及这些研究与新生儿免疫耐受的原理相符,并强调了在生命早期进行神经系统疾病基因治疗(或其他任何基因治疗方法)的益处。
AAV给药的一个普遍担忧是载体和/或转基因产物可能引起的炎症反应。Duba-Kiss和Hampson指出,CNS并非完全免疫豁免区:表达Cas9的新生小鼠表现出小胶质细胞的短暂激活,而成年小鼠不表达Cas9且观察到神经元损伤,这表明适应性免疫反应导致了部分转导细胞的清除。有趣的是,作者在新生小鼠成年后对其进行了载体再次给药,这次将AAV-Cas9注射到大脑的另一半球。这些小鼠体内Cas9蛋白的表达水平较低且并非在所有小鼠中被检测到,并且与小胶质细胞激活和神经元数量减少相关。这些发现表明,出生后首次AAV-Cas9给药能够减轻成年给药的炎症反应,但无法完全消除。这凸显了在体内实现外源蛋白(例如Cas9这种细菌来源的酶)持续表达的难度。其他AAV - Cas9研究也报道了载体给药后出现炎症和细胞衰老,以及靶组织中可以介导转导细胞的清除的CD8+ T细胞水平升高。
转基因产物抗体的产生可能带来挑战。已有报道称,成年小鼠体内可检测到针对AAV递送的CRISPR系统的体液免疫反应,但在新生小鼠中并不常见。Duba-Kiss和Hampson在新生小鼠和成年小鼠体内均检测到AAV9-Cas9给药后高水平的抗Cas9抗体。其他研究表明,接受低剂量AAV-CRISPR的新生小鼠血浆中Cas9水平极低,而接受AAV-IDUA治疗的犬和恒河猴新生幼崽脑脊液中未检测到抗体。用于CRISPR基因编辑的Cas核酸酶(如Cas9)来源于细菌;因此,它们是外源性的,并且可能在哺乳动物体内具有免疫原性。它们分布广泛,存在于某些肠道微生物群和一些常见病原体中;这意味着既往接触可能导致预先存在的抗Cas抗体和细胞反应,这些反应可能导致转导细胞清除,从而降低治疗效果并引发安全隐患。这凸显了将CRISPR-Cas系统应用于基因编辑所面临的挑战。尽管尚不清楚预先存在的抗Cas9抗体是否导致了Duba-Kiss和Hampson研究中观察到的Cas9水平,但他们的研究表明,新生儿免疫系统能够学会耐受Cas9。
AAV在给药途径、安全性和有效性方面具有多功能性,使其成为目前基因治疗应用(包括CNS疾病的治疗)的首选载体。由于血脑屏障(BBB)的限制以及神经网络的复杂性,将AAV递送至CNS极具挑战性。尽管某些AAV可以穿过血脑屏障,但通常需要全身给药高剂量;因此,在某些情况下,直接接种到大脑或CNS可能更为合适。
尽管AAV用途广泛且高效,但其接收大型转基因(约4.7 kb)的能力有限。因此,将CRISPR-Cas组件(向导RNA、Cas9蛋白及其调控元件)整合到AAV中较为困难,可能需要使用多个表达盒。一些Cas9蛋白,例如Duba-Kiss和Hampson等人使用的Cas9蛋白,最初来源于金黄色葡萄球菌,其长度(约3.2 kb)比其他Cas9蛋白(例如来自化脓性链球菌的Cas9蛋白,其长度约为4.1 kb)更短。无论如何,可以考虑联合使用多个AAV载体。
采用瞬时表达的基因编辑疗法治疗新生儿是理想的选择,并且可以减轻潜在的免疫反应。瞬时表达可以通过非病毒颗粒递送技术实现,例如脂质体和纳米颗粒,但递送可能存在局限性。控制AAV持续表达的一种方法是使用诱导型启动子;这是一种很有前景的策略,可以仅在需要时才产生蛋白质。
AAV介导的基因疗法在治疗CNS疾病(以及其他获得性或遗传性疾病)方面展现出巨大潜力,但免疫反应,尤其是针对外源性CRISPR-Cas组分(如Cas9)的免疫反应,构成了重要的挑战,尤其是对于成人患者。早期或新生儿给药有助于克服这些挑战,实现持久表达并最大限度地降低免疫原性,从而为更安全、更有效的基因编辑疗法铺平道路。
原文链接:
https://www.cell.com/molecular-therapy-family/methods/fulltext/S2329-0501(25)00235-9

地址:中国武汉东湖高新区光谷七路128号 市场:17720522078 人事行政:027-62439686 邮箱:marketing@genevoyager.com
BD 商务总台:17720514121 /13886000399(BD 经理) /17720515371(BD 经理)
本公司所有产品仅供实验科研使用,不用于人体疾病治疗及临床诊断。