2026-01-30
阿尔茨海默病(AD)是一种高发的神经退行性疾病,其主要特征是认知功能下降。但目前对AD潜在机制的理解仍不完整。利用腺相关病毒(AAV)构建AD小鼠模型并进行相关研究,以及开发新型基因治疗方法,正逐渐成为一种新兴的研究方向。对此,来自澳大利亚麦考瑞大学和新南威尔士大学的专家们回顾了利用AAV研究和构建AD模型的相关文献,并探讨了潜在的基因治疗策略。该综述被发表在《英国药理学杂志(British Journal of Pharmacology)》上。
劲帆生物医药科技(武汉)有限公司简称“劲帆医药”,创立于2022年,提供一站式病毒载体、蛋白和疫苗CRO/CDMO服务,拥有全球领先的Bac/Sf9规模化AAV制备专利技术平台及病毒载体/cGMP级蛋白/疫苗生产车间,致力于推进基因治疗药物、蛋白药物、治疗性疫苗更有效,更安全,更经济,更可及,赋能客户,造福患者。劲帆医药cGMP生产车间,包括4个P2级别种子建库区、5条蛋白/病毒生产线和1条灌装生产线,蛋白/病毒生产线生产规模分别为200 L和500 L,年最大产能可达50批次,目前已完成多项项目交付。
AD和鼠模型
神经病理学上,AD脑组织中可见β-淀粉样蛋白(Aβ)沉积形成细胞外斑块,以及由过度磷酸化的微管相关Tau蛋白构成的神经元内神经原纤维缠结(NFTs)。额颞叶痴呆(FTD)是第二常见的痴呆症类型。FTD的主要临床症状是行为以及语言障碍,通常伴有痴呆和运动障碍。值得注意的是,约一半的FTD是由潜在的Tau蛋白病理引起的,即在没有明显Aβ斑块的情况下存在NFTs。因此,Tau蛋白病理足以驱动神经退行性变,且对FTD的研究有助于理解AD。然而,在AD中,Aβ和Tau蛋白通过一系列分子过程相互关联,导致神经元功能障碍和丢失。目前AD发病机制的主流理论仍然是淀粉样蛋白级联假说,该假说认为Aβ的积累(由于其生成增加或清除减少)是疾病的起始事件。然而,随着时间的推移,已经提出了许多替代或补充理论。
绝大多数AD病例为散发性。此外,在家族性AD中也发现了致病突变。除了致病突变外,越来越多的除年龄外的遗传风险因素也被发现会增加患AD的可能性。这些因素包括载脂蛋白E4(APOE4),它是主要的遗传风险因素,以及脑源性神经营养因子(BDNF)、TREM2等。虽然在编码微管相关蛋白Tau(MAPT)的基因中尚未发现家族性AD突变,但该基因位点的致病突变已被发现是伴有Tau蛋白病理的家族性FTD的病因。
具体而言,在转基因小鼠中表达人源突变型APP可构建出具有类似人类Aβ斑块病理和记忆缺陷的体内模型。同样,表达人源突变型Tau蛋白的转基因小鼠也表现出类似AD/FTD的神经病理特征,包括过度磷酸化Tau蛋白的沉积和NFTs的形成。尽管转基因小鼠模型仍然是研究AD以及开发和测试新疗法的主要疾病模型,但近年来出现的基因递送机制为研究和潜在治疗神经退行性疾病提供了新的工具。在本综述中,研究者们回顾了使用重组腺相关病毒载体(rAAVs)在小鼠中构建、理解或治疗AD的相关文献(图 1)。
图1 AAV在推进AD研究和治疗方面具有巨大潜力
(图片来源:Lars M Ittner et al., Br J Pharmacol., 2019)
腺相关病毒——研究工具和基因治疗
AAV已成为中枢神经系统(CNS)靶向基因递送的首选载体,不仅可用于动物模型疾病机制的研究,也可用于神经退行性疾病的基因治疗。AAV作为基因递送系统,尤其是在CNS应用中的广泛应用,可归因于其非致病性、能够转导神经元并实现长期转基因表达以及轻微的免疫反应。此外,其结构简单的衣壳表面易于改造,从而可以构建具有靶向细胞嗜性和更高转导效率的载体。
AAV介导的脑内长期基因表达
凭借简便易用的实验方案,标准研究实验室即可采用可扩展的AAV载体生产和纯化方法。所生产的缺乏Rep蛋白的AAV无法整合到宿主基因组中。然而,由于AAV基因组的串联化以及其在细胞核内稳定的游离体持续存在,即使在有丝分裂后靶组织中也能实现长期转基因表达,且与其他病毒载体相比,AAV在长期基因表达方面更加稳定。注射后12个月,在小鼠脑内仍能检测到由胶质纤维酸性蛋白启动子驱动的ApoE表达,而通过腺病毒递送的相同构建体在6周后即停止表达。一项令人印象深刻的报告显示,在用AAV治疗1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)损伤的非人灵长类动物(NHP)帕金森病模型15年后,仍能检测到持续存在的载体基因组和治疗性多巴胺合成酶的表达。这些数据表明,单次给药后,AAV介导的转基因在CNS中的表达是持久的,甚至可能是终身的。AAV载体的这一特性不仅对啮齿动物疾病模型构建至关重要,而且对临床基因治疗也必不可少。
AAV血清型和脑细胞转导
利用AAV载体转导宿主细胞是一个多步骤过程,包括结合、摄取、转运以及最终的核脱壳。虽然所有AAV均通过通用细胞AAV受体(AAVR)感染细胞,但它们与AAVR的分子相互作用存在差异,这种差异具有血清型依赖性,并且对其他受体和辅助受体的特异性也不同。目前已鉴定出13种人类和非人灵长类动物AAV血清型和超过150种基因型,它们具有部分重叠但又不同的嗜性。血清型1、2、5、8、9和恒河猴(rh)10已广泛用于小鼠和其他物种(表 1)的CNS应用。
表1 比较AAV血清型在小鼠/大鼠CNS表达的精选研究
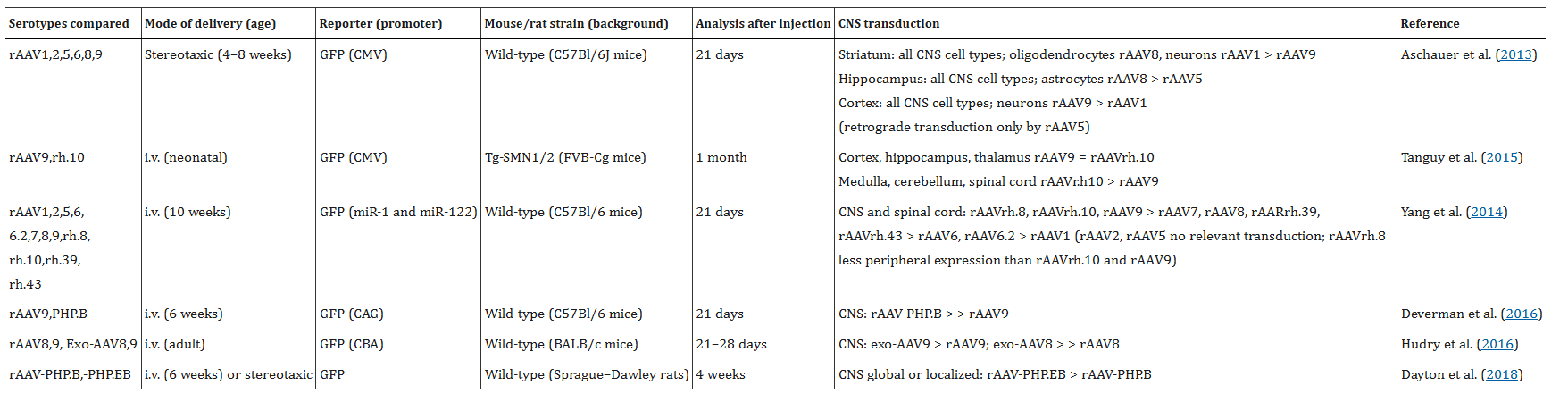
(表格来源:Lars M Ittner et al., Br J Pharmacol., 2019)
不同的AAV血清型通常能够转导所有主要脑细胞类型;然而,表达水平取决于所使用的启动子和血清型。启动子选择性已在神经退行性疾病的小鼠模型以及大鼠和非人灵长类动物中得到证实。研究数据表明,病毒启动子变体的差异活性扩展了AAV应用,为对胶质细胞功能进行基因修饰的AD研究人员提供了更多选择。另一种实现细胞类型特异性转导的潜在途径是在AAV变体表面展示高亲和力配体,使其靶向CNS细胞特异性细胞表面受体,类似于用于免疫细胞的方法。除了血清型和启动子外,转导效率还受多种因素影响,包括载体纯度、宿主CNS的成熟度、物种以及给药途径。
用于CNS表达的AAV系统性递送
多年来,人们开发了多种将基因递送至CNS的策略(图 2)。虽然在许多神经系统疾病的临床前模型中,使用立体定向手术将AAV直接递送至脑实质是安全有效的,但这种方法具有侵入性,且载体的扩散仍然有限。相比之下,脑室内和脑池内递送AAV可在小鼠和非人灵长类动物中实现广泛的表达,但这需要相当高的外科手术技巧和基础设施。静脉注射AAV作为一种递送方法,在技术上难度较低,并且随着Rh.10和AAV9成为首选载体而逐渐受到关注。然而,在将AAV转导应用于更大规模的模型或人类时,需要考虑不同物种间受体的差异:Rh.10和AAV9均能轻易穿过血脑屏障(BBB),静脉注射后,可在新生小鼠中有效转导CNS神经元;然而在成年小鼠中静脉注射AAV9病毒后,其嗜性转向神经胶质细胞;在接受静脉注射AAV9病毒治疗的非人灵长类动物中,这种转导作用除了作用于脑神经元外,还作用于脊髓。此外,不同血清型的表达动力学差异很大,其中AAV7和AAV9的表达启动速度最快。
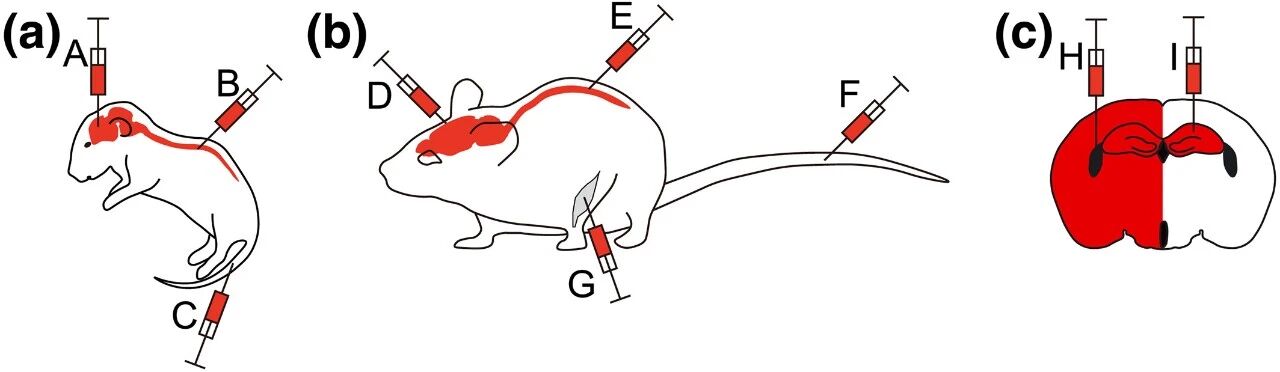
图2 小鼠中用于CNS基因表达的AAV递送方式有多种
(图片来源:Lars M Ittner et al., Br J Pharmacol., 2019)
静脉注射AAV9进入CNS实质的机制尚未完全阐明,可能为被主动摄取。在细胞血脑屏障样模型中,AAV9对内皮细胞的转导效率较低,但能够轻易穿过这些细胞;而AAV2对内皮细胞的转导效率较高,但无法穿过血脑屏障。尽管AAV9能够穿过血脑屏障,但其主要的转导仍发生在周围器官,尤其是肝脏。为了减少外周转基因表达(即去靶向),研究人员尝试通过心内注射rAAV9,实现了神经元基因表达,同时在周围器官中表达有限。此外,通过在rAAV9基因组中引入组织特异性互补miRNA结合位点,即使采用静脉注射,也能实现外周去靶向。
Deverman及其同事利用C57BL/6小鼠体内复杂的筛选方法,通过在AAV2/9的VP1基因第588和589位氨基酸之间插入一段7个氨基酸的肽段“TLAVPFK”,构建了一种改良的血脑屏障穿透型AAV9变体,命名为AAV.PHP.B。单次静脉注射AAV.PHP.B后,其转导CNS神经元和胶质细胞的效率比亲本AAV9高40-70倍,且在周围神经系统中观察到AAV.PHP.B对神经元靶向性的增强。该变体已被应用于突触核蛋白病小鼠模型的基因治疗。在成年大鼠或非人灵长类动物中,AAV.PHP.B的递送效率与其亲本AAV9相当或略高。一项通过静脉注射增强型变体AAV.PHP.EB在成年大鼠中进行的剂量反应研究表明,在肝脏和心脏中也存在显著转导的情况下,CNS表达显著增强。AAV.PHP.EB及其前体仍然是解决AD小鼠模型建模和机制问题的宝贵工具。
研究人员采用了其他AAV载体进化方法,其中一种方法成功构建了一种嵌合衣壳,该衣壳结合了亲代AAV2和AAV9血清型的受体结合特性。随后,研究人员利用这种AAV2g9编码靶向精神分裂症风险基因MIR137的引导RNA,并将其应用于CRISPR/Cas9敲入小鼠。结果表明,该AAV2g9能够高效特异性地转导小鼠CNS,且在肝脏中几乎没有或完全没有脱靶表达。这种理性的载体开发工程方法为CNS靶向治疗开辟了新的、充满希望的可能性。
另一个有望推进AAVCNS递送的途径是发现AAV与外泌体结合。在生产过程中,从培养基而非细胞裂解液中纯化的外泌体相关AAV9(exo-AAV9)已被证明能够有效穿过血脑屏障,并在全身或玻璃体内注射后感染脑细胞。exo-AAV的另一个优势在于,它们可以逃避常见的人类中和性抗AAV抗体,这些抗体在全身给药后会显著降低标准AAV制剂在CNS中的转导率。然而,这一优势是否适用于其他物种仍有待验证。
基于AAV的CNS基因治疗进展
近年来,锌指核酸酶和CRISPR/Cas等基因编辑工具已被用于体内靶向基因操作。在一项研究中,Zahur及其同事构建了一个编码锌指核酸酶对的AAV1/2载体,用于显著但不完全地降低小鼠脑内神经元组织蛋白酶D的表达。另一种方法是,通过AAV介导将gRNA递送至表达Cre依赖性Cas9的小鼠体内,并结合细胞类型特异性Cre小鼠品系,即可实现成年小鼠细胞类型特异性基因敲除。虽然这些系统仍需优化,但它们可能对未来旨在消除AD中显性致病等位基因的研究起到重要作用。
传统上,基因疗法通过将功能基因导入功能缺失的基因背景中来治疗单基因疾病。基因疗法产品在罕见病领域的商业化转化取得了显著进展,对于神经科学界而言,一项基于AAV9的基因疗法尤为重要:该疗法编码SMN蛋白,用于治疗儿童期脊髓性肌萎缩症(SMA)。临床试验显示,该疗法安全性良好,疗效显著。值得注意的是,AAV9载体以2×1014 vg·kg⁻¹的高剂量静脉注射给儿童患者,而该疗法仅在少数患者中引起血清转氨酶水平升高,且这些升高可通过泼尼松龙缓解;相比之下,一项采用猪和非人灵长类动物进行的研究,以剂量匹配的方式注射表达相同转基因的AAV9病毒,并以类似的方式给药,结果显示存在严重的载体和转基因相关毒性、运动神经元退化,甚至死亡。大型动物模型与临床观察结果之间的差异难以调和,但可能凸显了动物模型作为人类研究结果预测工具的固有局限性。
神经退行性疾病是一个涵盖多种疾病的统称,这些疾病的临床和病理表现多种多样且异质性很高。这进一步凸显了任何拟议基因疗法的复杂性。然而,基因疗法在视网膜营养不良等罕见疾病中的成功应用,为AD等复杂疾病的基因疗法奠定了基础。
AD基因疗法尚处于起步阶段,但近年来发展迅速。治疗的成功取决于能否有效且广泛地将基因转导至CNS。一项研究报告描述了编码人APOE2 cDNA的AAVrh.10的临床前开发以及在非人灵长类动物中优化给药途径的过程,结果表明,脑池内注射至枕大池的给药方式安全有效,并在整个CNS中产生了ApoE2-HA免疫反应性,提示该载体成功靶向了AD相关区域。事实上,已有研究报道了一种优化的非人灵长类动物脑脊液递送方案,该方案对ApoE2和其他AD候选靶点具有转化应用意义。AD基因治疗领域还有许多其他潜在方法,以下概述了三个针对不同通路的案例:(a)APP的α-分泌酶裂解产物APPsα也具有神经营养特性,因此被认为可用于AD的基因治疗。相应地,在已确诊AD缺陷的小鼠中,通过AAV介导的APPsα表达改善了记忆缺陷和突触改变。(b)人类AD和小鼠模型中均已报道存在神经元网络异常。目前,一种巧妙的治疗方法正在进行临床转化:将光遗传蛋白(即可通过光激活/失活的表面通道)导入5xFAD AD小鼠模型的大脑,以通过光照增强受损的神经元网络活性并改善功能缺陷。(c)一项研究发现,多聚谷氨酰胺结合蛋白1的不稳定是AD小鼠模型以及可能人类的突触和记忆缺陷的根本原因。该研究中AAV介导的多聚谷氨酰胺结合蛋白1的表达挽救了两种AD小鼠模型5xFAD和APP-KI的突触和行为缺陷。AD中大量潜在的基因治疗靶点值得在未来的综述中进行详细讨论。
基于AAV的AD小鼠模型
AAV 载体能够直接构建转基因小鼠,从而利用未转基因小鼠在体内研究相关通路(表 2)。这避免了饲养和维护大型小鼠群落以及杂交不同转基因品系的需要。AAV载体还允许并行测试多个基因/变体的组合。例如,将rAAV1/2注射到小鼠海马体中,即可同时表达K670M/M671L(瑞典)/T714I(奥地利)/V717I(伦敦)突变型APP(APP.SLA)或非突变型Tau或P301L突变型Tau,以构建AD模型。
表2 文章中讨论的基于AAV的AD啮齿动物模型的总结
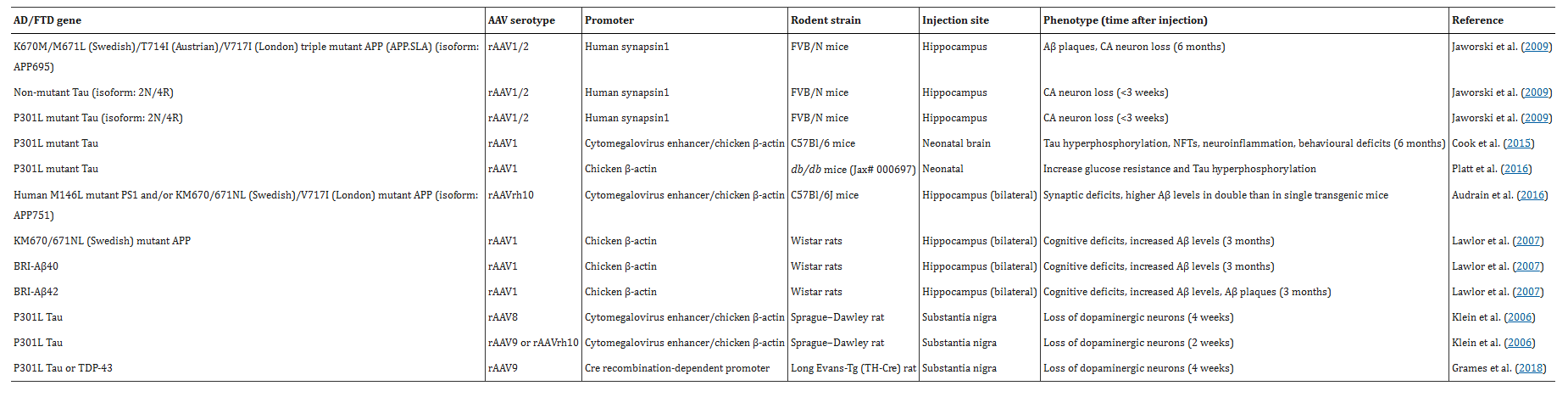
(表格来源:Lars M Ittner et al., Br J Pharmacol., 2019)
此外,AAV还可用于在其他常见疾病模型中诱导Tau蛋白病理,以研究合并症或共同疾病机制的影响。例如,流行病学和机制研究均表明,在接受实验性糖尿病的P301L Tau转基因小鼠中,AD和糖尿病与Tau蛋白磷酸化增加和NFT病理增强相关。rAAV1已被用于在新生db/db小鼠(一种2型糖尿病模型)中表达P301L Tau蛋白。与注射相同病毒的对照小鼠相比,注射AAV-P301L Tau的小鼠的葡萄糖抵抗和体重均增加。这与大脑中Tau蛋白磷酸化显著增加相关,提示胰岛素抵抗和Tau蛋白病理之间存在病理机制反馈。多种AAV血清型已被用于构建小鼠Aβ和Tau蛋白病理模型,为研究疾病机制提供了便捷的模型。
除了小鼠外,AAV也曾被用于构建大鼠AD模型。例如,研究人员使用重组腺相关病毒1型(rAAV1)在成年Wistar大鼠的海马体中表达KM670/671NL(瑞典)突变型APP或与BRI蛋白单独或组合连接的Aβ40或Aβ42序列。所有构建体均导致大鼠在术后3个月出现认知功能障碍和Aβ水平升高。在另一项研究中,rAAV8在3月龄Sprague-Dawley大鼠的海马体或黑质中赋予了强烈的GFP表达。另一项研究扩展了之前的工作,使用rAAV9在大鼠中表达Cre重组酶依赖性载体。在该模型中,P301L Tau蛋白和FTD相关TAR-DNA结合蛋白43的表达均能导致类似的神经元丢失。综上所述,虽然转基因AD大鼠模型的可用性限制了其在研究发病机制或治疗方法方面的应用,但使用AAV载体提供了一种以经济高效的方式克服这些限制的途径。
AAV用于研究AD机制
本文选取了三个当前的研究领域,旨在阐明AAV作为研究AD疾病机制工具的潜力。这三个领域包括:Aβ背景下的BDNF信号通路、突触后Tau蛋白机制以及Tau蛋白病理的扩散。
AD中的BDNF信号传导
BDNF促进神经元的存活和功能。在AD中,BDNF mRNA和蛋白水平均降低,这可能导致记忆障碍和神经元丢失。同样,在伴有Tau蛋白病理的神经退行性疾病中,BDNF表达也降低。此外,BDNF基因多态性与晚发性AD风险增加相关。Aβ可降低细胞内BDNF水平,Tau蛋白也能以类似方式降低神经母细胞瘤细胞以及转基因小鼠中的BDNF水平。有趣的是,在Aβ生成的APP转基因小鼠(APP23品系)中,当敲除Tau蛋白后,BDNF水平得以恢复。将rAAV8注射到3月龄pR5小鼠的侧脑室中表达BDNF,可预防12月龄小鼠的记忆缺陷和突触/神经元丢失,但不会改变Tau蛋白病理。BDNF具有神经保护作用,但其前体proBDNF却具有相反的作用。在5月龄的Aβ形成型AD小鼠(APP/PS1品系)中通过AAV介导表达proBDNF,在脑室内注射病毒8周后,会加剧记忆缺陷、Aβ水平和病理。阻断或敲除p75神经营养受体(p75NTR)可消除AAV-proBDNF在原代神经元中的神经退行性作用。有趣的是,p75NTR也被描述为AD发病机制中的Aβ受体。而p75NTR的胞外结构域(p75ECD)在α-分泌酶切割后释放到细胞外,可以保护细胞免受Aβ毒性作用。因此,向Aβ形成APP/PS1小鼠脑内注射AAV以表达p75ECD,可以改善其记忆缺陷。一项精妙的后续研究表明,在3月龄APP/PS1小鼠中通过肌注rAAV8诱导p75ECD外周表达,可在12月龄时改善记忆缺陷,降低APP/PS1小鼠的Tau蛋白过度磷酸化水平,并减轻神经炎症。此外,接受治疗的小鼠体内Aβ负荷降低,这可能是由于外周为脑内Aβ提供了一个“清除”途径。p75ECD表达缺乏明显的外周效应,但其在APP/PS1小鼠中表现出有益的中枢效应,这支持将p75ECD作为AD的基因治疗靶点。
AD中的突触后Tau蛋白
根据淀粉样蛋白级联理论,Aβ病理的积累是疾病的起始阶段,而过度磷酸化、聚集和Tau蛋白沉积等事件则是AD的下游事件。在细胞培养和动物模型中,Aβ都需要Tau蛋白来介导其毒性。在此背景下,此前已证明Aβ的毒性是由突触后Tau蛋白介导的,这一过程涉及突触后致密区蛋白95(PSD95)、Src激酶Fyn以及N-甲基-D-天冬氨酸受体下游的Tau蛋白组成的蛋白复合物。研究者们发现p38激酶亚型γ(p38γ)通过磷酸化Tau蛋白的酪氨酸(T)205 位点来调控PSD95/Fyn/Tau 复合物。因此,p38γ的活性导致突触后Tau蛋白的T205位点磷酸化,进而导致PSD95/Fyn/Tau蛋白复合物解离,从而抑制Aβ毒性。在原代神经元中,通过AAV介导表达活性p38γ变体可减轻Aβ毒性,更重要的是,还能预防突变型APP转基因小鼠(APP23品系)的记忆缺陷和神经元网络异常。为了说明T205磷酸化在此过程中的重要性,研究人员利用AAV将点突变变体导入Mapt缺陷小鼠体内;结果发现,表达非突变型和T205A变体的Tau蛋白会使Mapt缺陷神经元再次对兴奋性毒性敏感,而表达模拟磷酸化变体T205E的神经元则仍然具有保护作用。这项工作凸显了AAV在体内以时间敏感的方式测试蛋白质多种变体的潜力。从概念上讲,这项工作挑战了长期以来认为Tau蛋白磷酸化完全是由疾病驱动的事件的观点,并表明需要进一步研究Tau蛋白在特定位点磷酸化的生理和病理意义。在治疗方面,降低Tau蛋白水平已被认为是一种预防人类AD进展的途径。利用反义寡核苷酸降低P301S突变Tau转基因小鼠(PS19品系)中人源Tau蛋白的水平,可预防神经元丢失、改善功能缺陷并延长生存期。针对Tau蛋白的反义寡核苷酸也能降低非人灵长类动物模型中该蛋白的水平。在成年(7月龄)未接受过任何处理的C57Bl/6小鼠中,利用AAV介导的shRNA表达靶向Tau mRNA并降低其蛋白水平,会导致运动障碍和记忆缺陷。当短暂的Tau蛋白敲低结束后,这些缺陷是可逆的,表明该蛋白是成年哺乳动物大脑记忆形成所必需的。尽管Tau蛋白发挥这种生理功能的确切机制尚待阐明,但急性Tau蛋白水平降低与BDNF和突触蛋白水平降低以及脊柱密度下降相关。这些发现可能对AD及其他伴有Tau蛋白病理的神经退行性疾病的Tau蛋白降低治疗策略具有重要意义。因此,可能需要更精准地靶向Tau蛋白依赖性疾病机制。相应地,在神经元中特异性表达p38γ变体以特异性磷酸化突触后Tau蛋白的保护性位点,可能成为AD基因治疗的新途径。
AD中Tau蛋白病理的扩散
脑内Tau蛋白病理的空间分布与AD的临床症状进展相关。NFT病理起始于内嗅皮层(EC),并遵循疾病特异性模式,通过神经元连接从一个脑区扩散到下一个脑区。利用局部转基因Tau蛋白表达可以在小鼠中模拟Tau蛋白病理的扩散,但这受限于目前的表达技术。将AD脑提取物和重组Tau蛋白原纤维注射到人源Tau蛋白转基因小鼠脑内,均可诱导NFT病理的形成。此外,AAV已被用于在特定脑区局部表达Tau蛋白,以研究Tau蛋白病理在小鼠模型中的扩散。使用rAAV2/9在未接受过任何处理的CD-1小鼠的EC中表达人源P301L突变Tau蛋白,导致海马体穿通通路退化,并在注射后10周,Tau蛋白扩散至齿状回(DG)神经元。后续研究进一步表明,当与表达P301L Tau蛋白的rAAV2/9共注射时,rAAV2/9-GFP可从EC转移至DG神经元,这提示在这些模型中,神经元间的扩散可能并非由蛋白质转移引起,而是由AAV的转移本身造成。值得注意的是,雷帕霉素可阻止AAV的跨突触转移和EC的神经退行性变。在另一项研究中,研究人员使用rAAV2/6在C57Bl/6小鼠的内侧EC中局部表达P301L突变的全长Tau蛋白。28天后,在DG相互连接的神经元中检测到了人源Tau蛋白,并在体内迅速扩散。在这些小鼠中,小胶质细胞的耗竭和外泌体形成的抑制显著减少了Tau蛋白的扩散,这表明小胶质细胞对神经元释放的Tau蛋白的摄取和处理是疾病中Tau病理在神经元间传播的一个组成部分。共注射表达GFP的AAV病毒表明,该模型基于Tau蛋白的扩散,而非AAV病毒在DG内的扩散或传播。不同研究中AAV病毒扩散结果的差异也可能是由于所使用的AAV血清型不同所致。为了研究Tau蛋白在神经元内的扩散,研究人员引入了一种不同的方法:使用编码人P301L突变Tau蛋白和eGFP的AAV构建体,二者通过2A自切割序列连接(AAV-eGFP-2A-huTauP301L)。2A序列发生翻译后自切割,导致经rAAV8转导的“供体”神经元中Tau蛋白和GFP表达,而未感染的“受体”神经元(已摄取来自表达Tau蛋白的相互连接细胞释放的Tau蛋白)仅表达Tau蛋白,不表达GFP。将AAV-eGFP-2A-huTauP301L局部注射到未经处理的C57Bl/6小鼠的EC中,导致Tau蛋白扩散至DG受体神经元;微透析结合电刺激在自由活动小鼠脑中证实,Tau蛋白以活动依赖的方式从神经元释放。Schultz及其同事在此基础上利用AAV介导的基因表达研究了神经元活动对非突变型人Tau蛋白在原代神经元和小鼠中扩散的影响。在该研究中,使用rAAV2和rAAV8分别表达了全长Tau蛋白(2N4R)和一种仅能被特定药物激活的兴奋性设计受体(DREADD)。用氯氮平N-氧化物(CNO)处理表达Tau蛋白/DREADD的细胞,导致神经元活性(通过Ca²⁺成像测定)和Tau蛋白释放均呈剂量依赖性增加。将CNO注射到11周龄未接受过任何处理的小鼠的腹侧海马体中,每日两次,持续8周,结果显示,与载体对照组相比,注射脑区的Tau蛋白病理显著加重,并且Tau蛋白扩散至相互连接的脑区。这种扩散与受体脑区神经退行性变的迹象相关。当将AAV-Tau/DREADD注射到Mapt −/−小鼠中并用CNO治疗时,也获得了类似的结果,证实了在Mapt −/−背景下局部表达P301L Tau的转基因小鼠的发现,即内源性Tau蛋白不是转基因Tau扩散所必需的。
AD小鼠模型中的基因治疗策略
针对Aβ的免疫疗法已通过多项临床试验取得进展,并取得了一些令人鼓舞的近期成果。在AD小鼠模型中,针对Aβ的主动和被动疫苗接种均能清除斑块病理并改善记忆缺陷。目前,AAV已被用于AD小鼠的临床前研究中,以表达抗体或抗原。例如,将编码与霍乱毒素B融合的Aβ42序列的AAV(AAV-CB-Aβ42)通过不同途径(口服、肌肉注射和鼻内给药)导入V717I(伦敦)或V717F(印第安纳)突变型APP转基因小鼠,以获得稳定的循环抗Aβ抗体水平。无论是在1月龄时进行预防性治疗,还是在12月龄时对PDAPP小鼠进行治疗性干预,均能改善记忆缺陷并降低Aβ负荷,且与AAV递送途径无关。另一项研究表明,口服编码不同Aβ变体(AAV/Aβ)的AAV(即Aβ aa1–43和Aβ aa1–21)后,小鼠肠道上皮细胞中均检测到了这些变体的表达,并且在治疗后6个月以上仍能检测到针对Aβ的循环抗体滴度。AAV/Aβ治疗的突变型APP转基因小鼠(Tg2576品系)在未检测到T细胞反应的情况下,Aβ负荷也显著降低。在一项后续研究中,研究人员对10月龄的Tg2576小鼠进行了AAV/Aβ口服治疗,结果显示,小鼠在12-13月龄时记忆力得到改善,脑内Aβ沉积减少。这些改善发生在脑部淋巴浸润未发生的情况下。另有研究表明,APP转基因小鼠经AAV/Aβ治疗后,抗体诱导的Aβ清除是通过自噬介导的。这些发现启发了人们利用AAV在AD小鼠模型中表达抗体作为一种类似被动免疫的方法。因此,研究人员使用CMV启动子驱动的构建体,通过rAAV1将抗Aβ抗体肌注到Tg2576小鼠体内。该构建体表达由可自切割的弗林蛋白酶2A连接子连接的抗Aβ IgG重链和轻链。接受治疗的小鼠在两组分别于5月龄(预防组)和10月龄(治疗组)注射的Tg2576小鼠中,均表现出持续的循环抗Aβ抗体水平和显著降低的Aβ负荷。类似地,将rAAVrh.10双侧注射到2至3月龄的P301S Tau转基因小鼠(hTau.P301S品系)的海马体中,以表达抗磷酸化Tau抗体PHF1的序列。6月龄时,接受治疗的小鼠体内磷酸化和不溶性Tau蛋白的含量显著降低,海马体体积增大。
另一种方法是在APP转基因小鼠中利用AAV表达针对Aβ的单链抗体(scFv)。scFv是IgG的截短变体,由IgG重链和轻链的可变区(抗原识别区)通过连接序列连接而成。scFv保留了结合抗原的能力,但缺乏抗原交联和T细胞受体激活特性。针对Aβ和Tau蛋白的重组scFv已被用于分别减轻突变APP和Tau转基因小鼠的病理损伤并改善其功能缺陷。在表达突变型APP、PS1和Tau蛋白的三转基因小鼠(3xTgAD品系)中,海马体内注射rAAV1以表达源自M13噬菌体文库的抗Aβ scFv,可降低Aβ负荷、Tau蛋白磷酸化水平并改善记忆缺陷。该方法使用CMV启动子驱动抗Aβ scFv在不同的CNS细胞类型中表达。因此,其作用可能由分泌型以及细胞内scFv共同或分别介导。类似地,在10月龄的双转基因突变型APP/PS1小鼠中,脑室内注射rAAV5以表达抗Aβ scFv,5个月后检测发现脑组织和脑脊液中的Aβ负荷降低。与之前的研究不同,本研究在接受治疗的小鼠中发现了微出血以及脑淀粉样血管病变加重。研究人员使用CMV增强子/β-肌动蛋白启动子驱动抗Aβ scFv的表达。有趣的是,使用rAAV1递送相同的构建体可导致神经元凋亡和小胶质细胞反应,而使用rAAV2则仅产生有限的表达。scFv的变体,称为胞内抗体,已被用于靶向细胞内Aβ,当通过rAAV2递送至2月龄3xTgAD小鼠的脑内时,可显著降低Aβ和Tau蛋白的病理负荷。靶向Tau蛋白的scFv也显示出在预防pR5小鼠的神经病理和功能缺陷方面的疗效。同样,在出生时脑室内注射AAV表达的针对人Tau蛋白的scFv,可在不引起促炎反应的情况下降低衰老PS19小鼠体内Tau蛋白的磷酸化和沉积。此外,将rAAV5注射到3月龄P301L Tau转基因小鼠(JNPL3品系)的海马体中,以表达源自构象抗Tau抗体MC1的scFv。注射四个月后,这些小鼠的Tau蛋白过度磷酸化、聚集和不溶性显著降低。综上所述,AAV介导的scFv表达在APP和Tau蛋白相关的AD小鼠模型中均显示出治疗效果,且炎症反应良好。值得注意的是,只有一小部分循环抗体能够进入大脑。这可能限制了AAV在外周抗体表达方面的应用,类似于传统的主动和被动疫苗接种。使用AAV在大脑中直接表达抗体或其变体可以克服这些限制,但其在人体中的转化应用仍有待验证。
CRISPR/Cas9基因编辑技术的引入不仅彻底改变了转基因小鼠(以及其他物种)的构建方式,也为多种疾病的基因治疗提供了新的思路。将CRISPR/Cas9基因编辑与AAV基因递送相结合,或许是一条可行的途径。因此,György及其同事将外泌体AAV9注射到成年Tg2576小鼠的海马体中,以递送突变型KM670/671NL APP(APPswe)等位基因特异性gRNA和Cas9。他们发现,在所有注射小鼠(n = 5)中,1.3%的APPswe等位基因发生了特异性破坏(即插入/缺失)。相比之下,携带APPswe基因的人类成纤维细胞中插入缺失突变的发生率要高得多,这些携带者的基因组中仅含有两个APPswe拷贝。这项概念验证研究强调了基因靶向治疗作为家族性AD潜在治疗途径的可能性,以及AAV在其中的潜在作用。预计在不久的将来,该领域的深入研究将取得重大进展,而重点在于基因校正。
总结
尽管转基因小鼠模型仍然是AD研究的主要体内“工具”,但AAV在该领域的应用正在稳步增长。AAV最常用于研究候选基因对AD神经病理或功能表型的影响,其优势在于可以直接在已建立的AD小鼠模型中测试基因功能和变异,而无需事先进行不同遗传品系的杂交。这使得更多人群能够使用转基因小鼠。然而,AAV也存在一些固有的局限性,例如其相对较小的5 kb包装容量,这限制了其在研究大片段DNA方面的应用。此外,由于转导细胞的异质性和比例,AAV递送后不同动物间的表达水平模式存在差异,因此需要更多数量的动物进行实验,并评估所有受试动物的解剖靶向性和转基因表达情况。尽管如此,AAV已经并将继续拓展在小鼠模型中研究AD的应用,且为研究其他物种(包括非人灵长类动物)中的AD提供了契机。
除了在疾病机制研究中的价值外,AAV还可能在包括AD在内的神经退行性疾病的潜在基因治疗中发挥重要作用。随着基于AAV的基因疗法获得FDA批准用于治疗罕见疾病,过去阻碍AAV作为常见疾病治疗方案的障碍将会继续消除。
参考文献:
https://bpspubs.onlinelibrary.wiley.com/doi/10.1111/bph.14637

地址:中国武汉东湖高新区光谷七路128号 市场:17720522078 人事行政:027-62439686 邮箱:marketing@genevoyager.com
BD 商务总台:17720514121 /13886000399(BD 经理) /17720515371(BD 经理)
本公司所有产品仅供实验科研使用,不用于人体疾病治疗及临床诊断。