2025-09-17
背景介绍
水痘带状疱疹病毒(Varicella zoster virus, VZV)是一种具有高度传染性的α疱疹病毒,初次感染可引起水痘,此后病毒会终生保持潜伏状态,当免疫力下降时可再次激活引发带状疱疹(Herpes zoster, HZ)。该病以节段性皮疹和疼痛为主要特征,可能进展为带状疱疹后神经痛(Postherpetic neuralgia, PHN),这种疼痛可持续数年且难以治愈,其发病率随年龄增长而上升,老年人与免疫抑制人群为高发群体。全球范围内,带状疱疹年发病率约为每千人2.9至19.5例,女性患病风险更高。在美国,每年约报告100万例带状疱疹病例,造成约13亿美元医疗费用支出。在中国,带状疱疹年发病数相对有限,且存在地域差异。带状疱疹及其并发症PHN严重影响患者生活质量,并给医疗系统带来显著经济负担。
1.水痘带状疱疹疫苗在研及上市概况
截至2025年8月25日,全球水痘带状疱疹疫苗临床在研及申请批准和已上市的管线有44个。其中重组亚单位疫苗为20个(预防性疫苗),mRNA疫苗有17个(16个预防性疫苗,1个治疗性疫苗),减毒活疫苗有6个(预防性疫苗),缺陷型病毒疫苗有1个(预防性疫苗)。(来自智慧芽数据库)
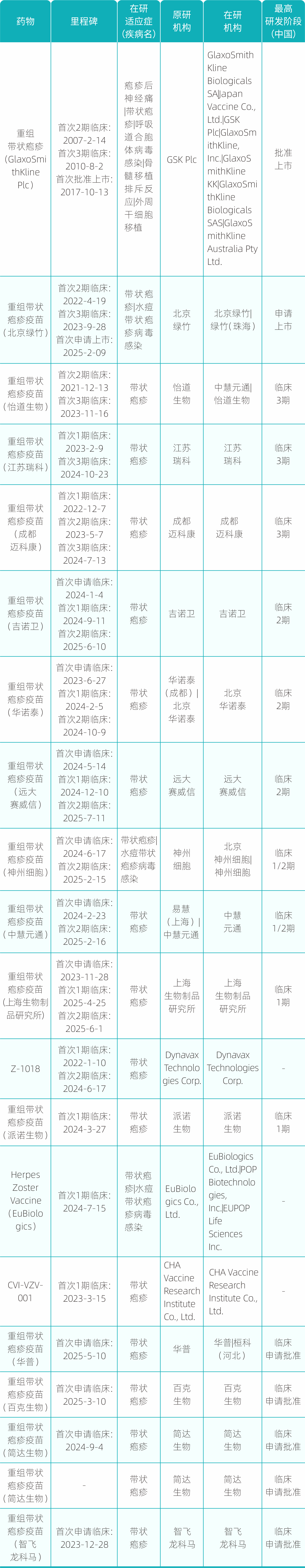
国内目前已上市的水痘带状疱疹疫苗有:重组带状疱疹疫苗—Shingrix® (GlaxoSmithKline Plc,2017年上市,2019年国内上市);带状疱疹减毒活疫苗—感维(长春百克生物,2023年国内上市);2023年上半年,Shingrix®仅在半年时间就于全球市场取得了高达21.87亿美元的收入,同比增长20%,在全球十大畅销疫苗中排名第三。
HZ/su(Shingrix®)是一种重组糖蛋白E(gE)亚单位疫苗,由50μg重组水痘带状疱疹病毒糖蛋白E和基于脂质体的ASO1B佐剂系统组成。目前全球公认最有效的带状疱疹疫苗HZ/su虽然保护效果超过90%,但其采用的AS01B佐剂系统会导致87%的接种者出现不良反应,约10%的接种者在接种后7天内出现3级不良反应,且高昂的价格限制了其在发展中国家地推广。
LZ901(北京绿竹生物,重组亚单位水痘带状疱疹疫苗)是一种针对带状疱疹减毒活VZV毒株(Oka)的新型gE-Fc融合蛋白疫苗,VZV-gE胞外域的羧基端连接到IgG1的Fc片段上,基于VZV-gE形成共价二聚体的特性,利用多步液相色谱过程,从成分复杂的蛋白溶液中纯化得到含有两个Fc的高纯度重组VZV-gE四聚体-Fc融合蛋白,并辅以氢氧化铝作为佐剂。该疫苗具有的优势:1 副作用小,安全性高;2 产生更有效的细胞免疫,全程接种2针;3 与进口疫苗Shingrix®相比(1600元/针),更具价格优势。LZ901有望成为进展最快、国内唯一且首家批准上市的VZV疫苗。
2.LZ901与HZ/su疫苗的比较研究
临床前研究——小鼠模型中免疫原性的比较
研究人员系统比较了疫苗LZ901与已上市疫苗HZ/su(Shingrix®)在小鼠模型中诱导的免疫反应。在体液免疫方面,两者均能高效激发gE特异性抗体,且抗体水平无显著差异;随后采用FAMA试验检测血清中的VZV抗体,发现两组间的FAMA滴度无显著差异,证明LZ901诱导中和抗体的能力与HZ/su相当。在细胞免疫方面,LZ901展现出更全面的T细胞应答,包括更高水平的多功能CD4+和CD8+T细胞活化及细胞因子分泌。特别是在CD4+T细胞中,IL-2、IL-4和CD40L的表达显著高于HZ/su组。结果表明,LZ901在诱导中和抗体和细胞免疫方面均与HZ/su相当,甚至在部分T细胞免疫指标上表现更优,显示出良好的开发潜力。(图1和表1)
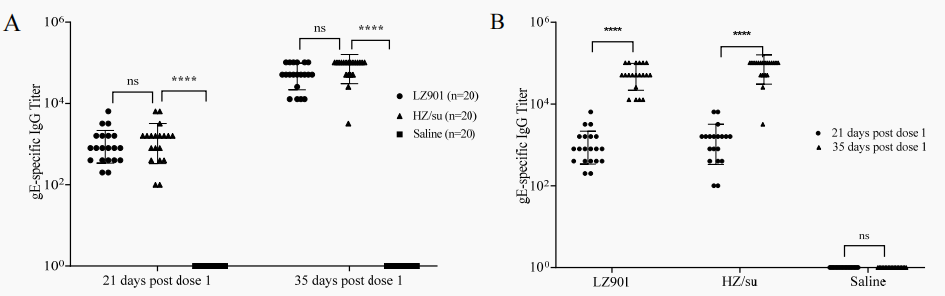
图1 首次免疫后第21天和第35天血清中gE特异性IgG分析
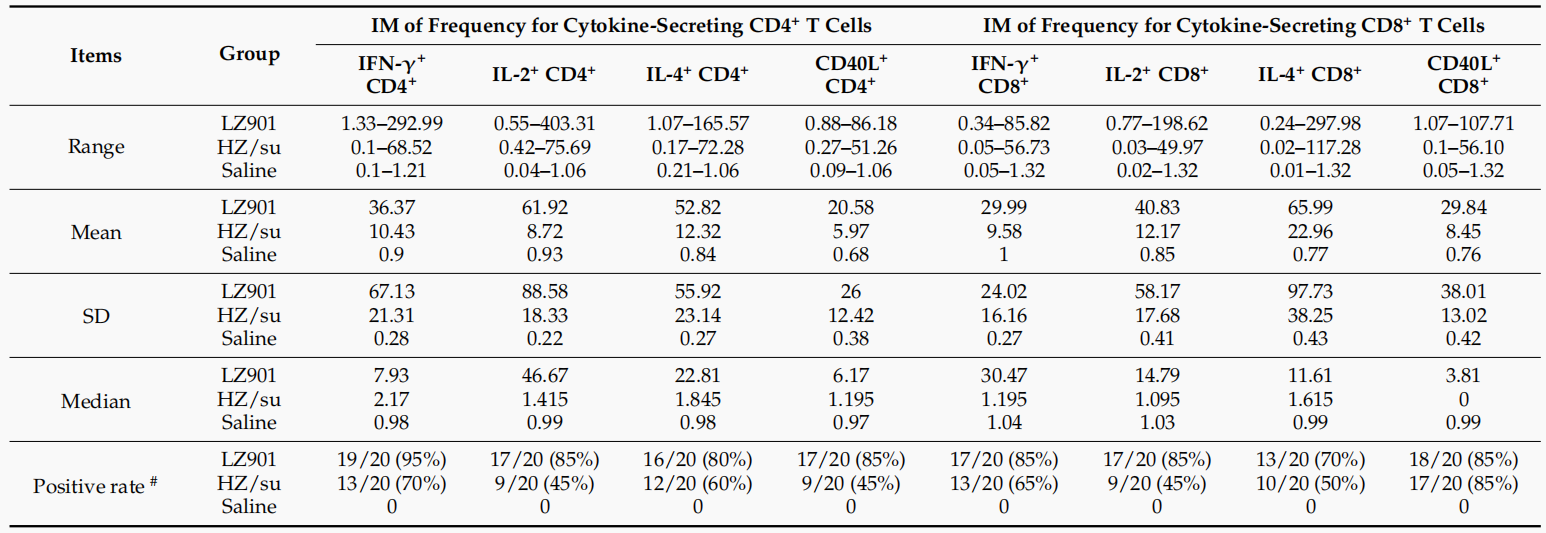
表1 分泌细胞因子的CD4+与CD8+T细胞频率的增加倍数(IM)
以上数据来源:Quan Y et al, Vaccines (Basel)., 2024
临床研究——头对头比较试验分析
该研究招募了301名50岁或以上的健康成人,其中至少291名健康成人接种了两剂LZ901或HZ/su疫苗。研究结果显示,与HZ/su疫苗相比,LZ901在50岁或以上成人中诱导出更优的细胞免疫原性和表现出更佳的安全性,详细结果如下:
更优的细胞免疫原性:LZ901在诱导gE特异性T细胞免疫应答方面显著优于HZ/su。LZ901组CD4+和CD8+T细胞反应阳性率分别为83.0%和46.8%,显著高于HZ/su组的58.1%和8.8%,且差异均远超非劣效界值。(表1)
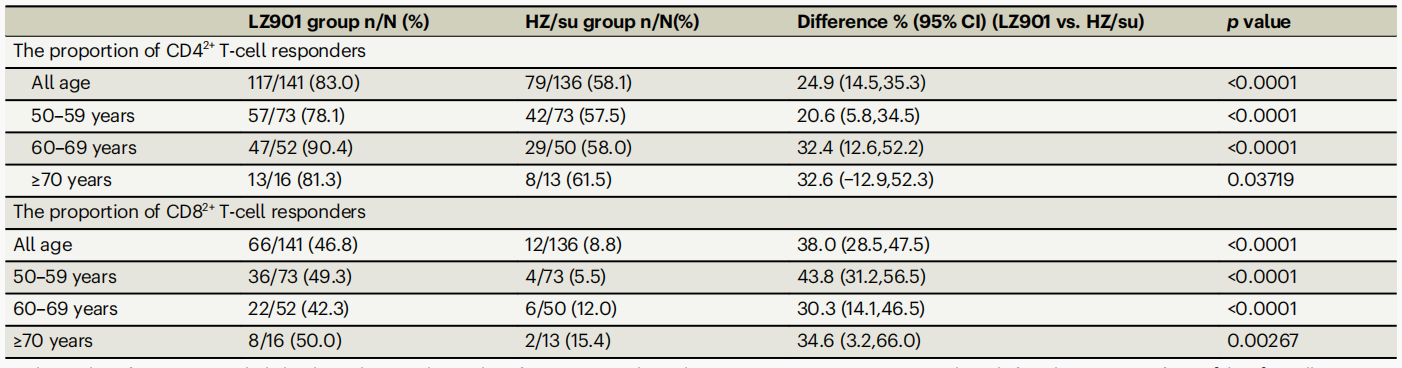
表1 同时对≥2种细胞因子产生阳性反应的参与者比例
副作用小,安全性高:接种后30天内,LZ901组不良反应发生率显著低于HZ/su组(41.1% vs 87.9%)。局部反应(27.2% vs 82.6%)和全身性反应(14.6% vs 54.4%)发生率均显著较低,且LZ901组发生常见不良反应如发热(1.3% vs 42.9%)、乏力(5.9% vs 27.5%)、头痛(1.9% vs 13.4%)等均显著更低。大多数反应为轻中度,严重不良事件均与疫苗无关(两组各报告4例)。(表2)
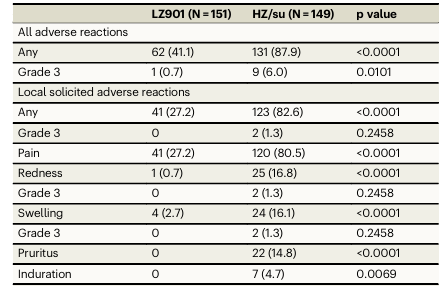
表2 接种疫苗后30日内发生的不良反应
另外,LZ901诱导的多功能T细胞(同时分泌3-4种细胞因子)比例更高,且关键细胞因子(如IFN-γ、IL-2)的分泌频率显著提升(图1)。在体液免疫方面,两剂疫苗均能显著提升抗体水平且血清转化率相当,但LZ901组的抗体浓度低于HZ/su组。
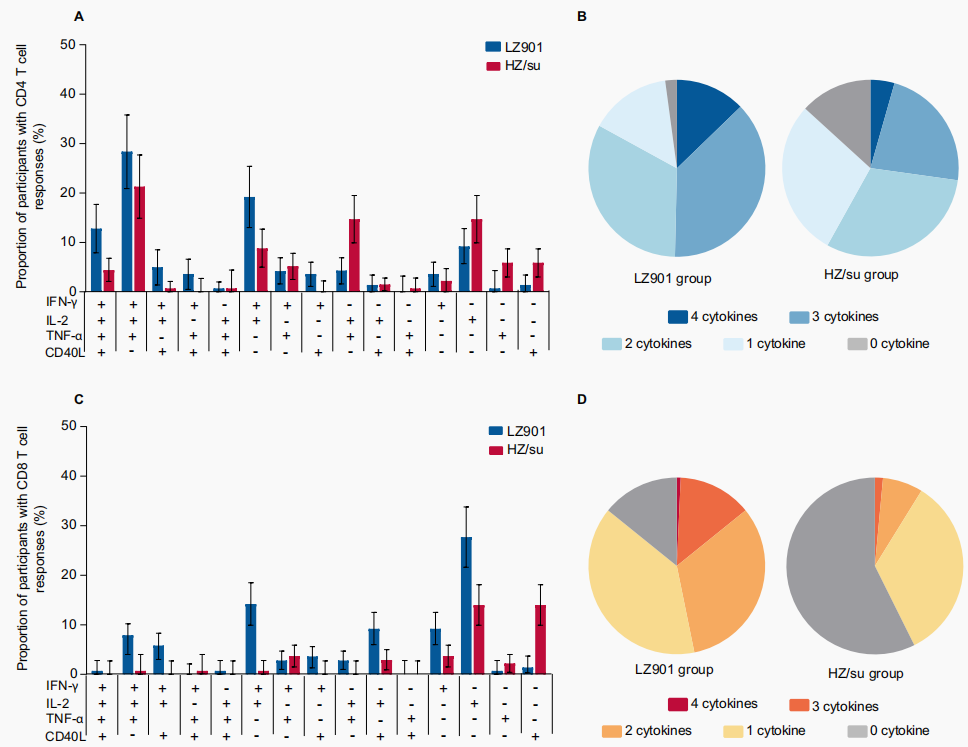
图1 同时对多种细胞因子产生阳性反应的参与者比例
以上数据来源:Jin PF et al, Nat Commun., 2025
以上结果充分说明,LZ901疫苗在免疫效果与安全性之间,展现出更理想的平衡。
劲帆医药
重组蛋白疫苗开发及生产服务
昆虫杆状病毒表达系统是研发重组亚单位疫苗的关键技术平台之一。该平台凭借其在抗原设计灵活性、快速高效的生产能力以及诱导强效免疫应答等方面的突出优势,相较于其他系统具有显著竞争力。目前,已有Flublok®、Weikexin、Porcilis® Pesti、BAVOVAC CSFE2®等多款人用/兽用疫苗产品获批上市。
劲帆医药致力于为细胞基因治疗药物、重组蛋白及治疗性与预防性疫苗提供一站式研发、生产及药效评价服务。公司拥有领先的规模化AAV制备专利技术平台及GMP级生产车间,已成功支持多项IIT/IND(中美)AAV/重组蛋白疫苗药物申报,助力帕金森、难治性癫痫等疾病的基因治疗药物进入临床研究阶段。其中乙肝/肿瘤治疗性疫苗等项目已完成美国FDA IND申请,并推动部分项目进入I期临床研究。劲帆医药以助力顶级科研,加速创新药临床转化为使命,赋能合作伙伴,造福患者。
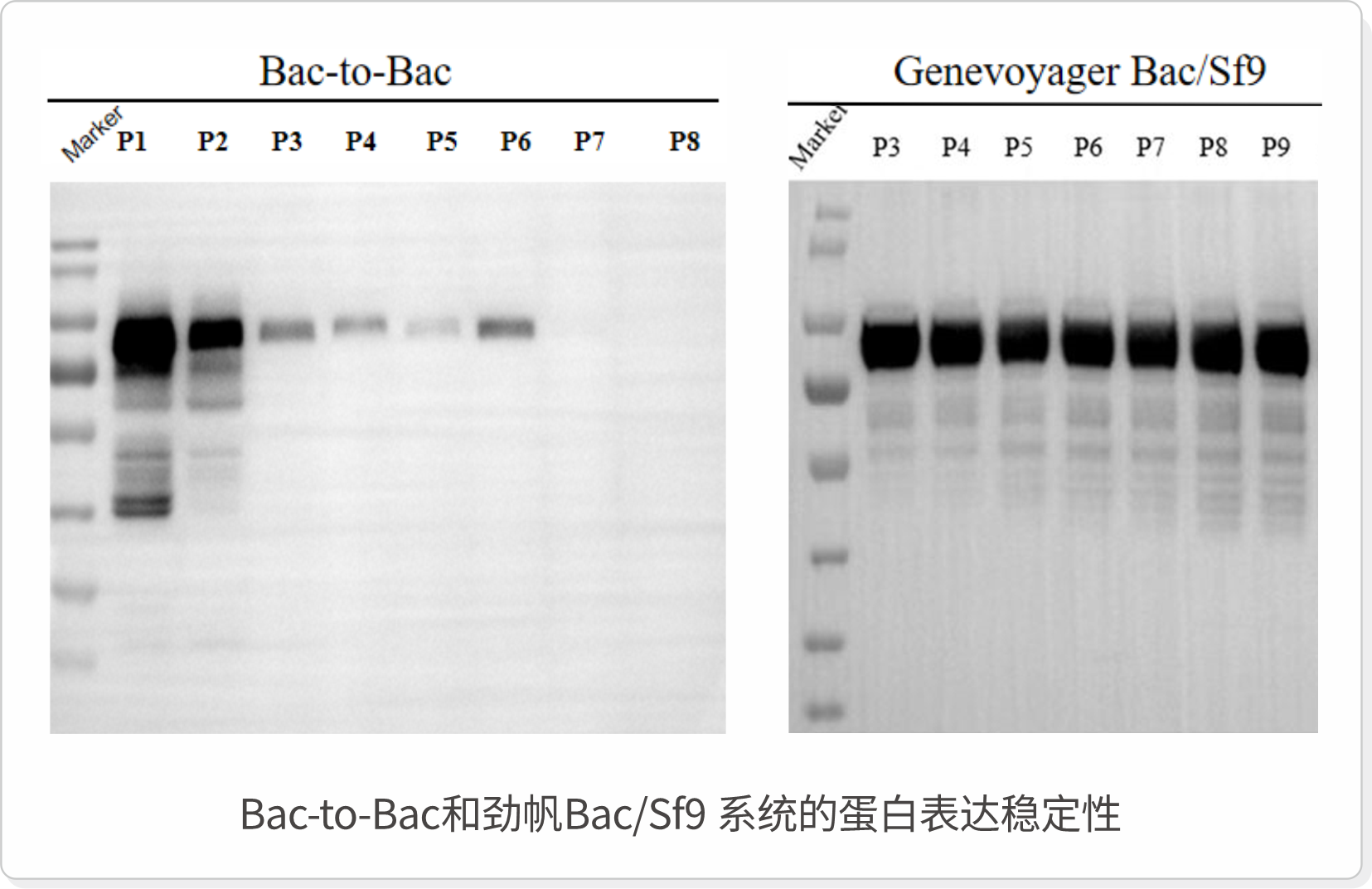
劲帆Bac/Sf9系统通过解决传统Bac-to-Bac技术的核心问题,为重组蛋白的生产提供了更高效、更稳定的解决方案,其高效的重组效率、优良的传代稳定性以及高批间一致性,使其在大规模生产中具有显著优势,为疫苗开发、生物制药和科研领域带来了重要的技术突破。
—劲帆Bac/Sf9昆虫杆状病毒系统一站式解决方案—
—劲帆Bac/Sf9系统助力创新疫苗商业化成功—
—项目案例—
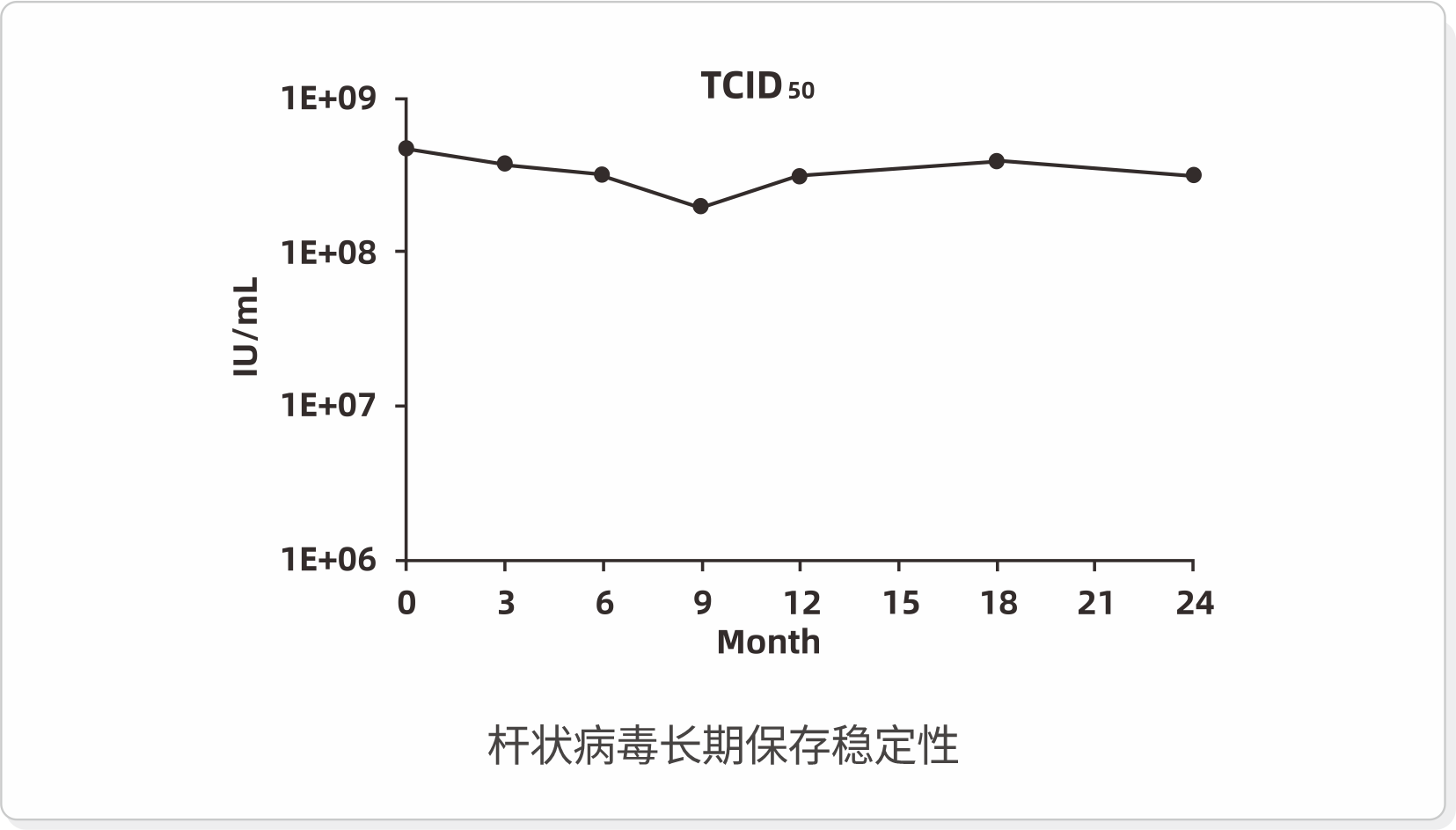
高稳定性
≤-80℃下,杆状病毒的长期保存稳定性已持续监测24个月,毒种感染活性稳定性良好。
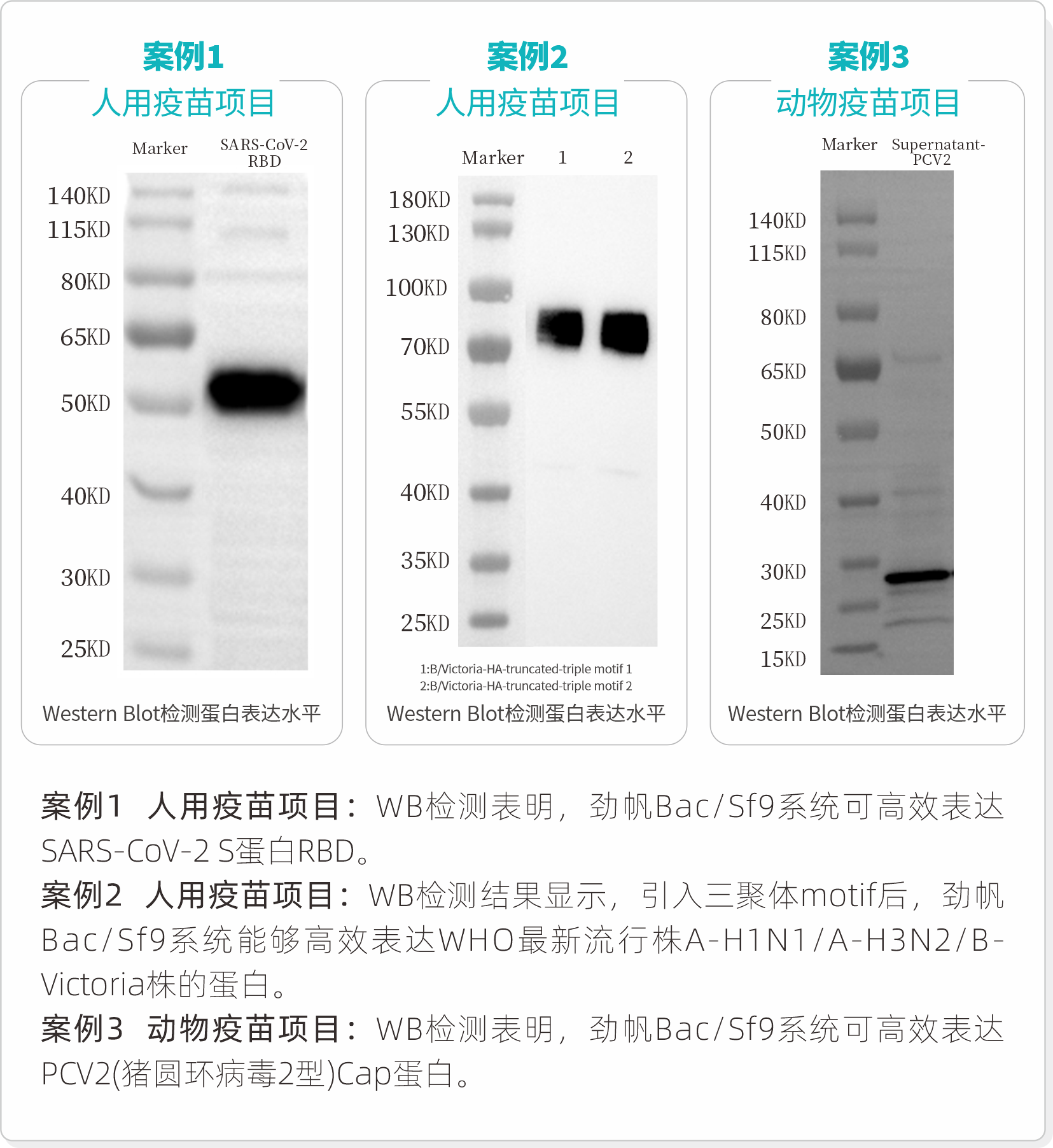
高产率
劲帆Bac/Sf9系统已在人用疫苗、动物疫苗的生产中进行测试,展现出高产、快速表达和可规模化生产的优势。

地址:中国武汉东湖高新区光谷七路128号 市场:17720522078 人事行政:027-62439686 邮箱:marketing@genevoyager.com
BD 商务总台:17720514121 /13886000399(BD 经理) /17720515371(BD 经理)
本公司所有产品仅供实验科研使用,不用于人体疾病治疗及临床诊断。