2025-11-17
昆虫细胞表达系统能够快速、精确、安全地生产创新疫苗候选物,且已促成多款针对包括新冠病毒在内的传染病疫苗的研发和上市,如诺瓦瓦克斯(Novavax)新冠疫苗等。随着技术和监管指南的不断完善,昆虫细胞表达系统作为一种极具前景且用途广泛的生物制药生产平台,正日益受到关注。
近日,四川大学华西医院的研究人员于Journal of Biological Engineering上发表了一篇题为Insect cell expression system: advances in applications, engineering strategies, and bioprocess development的综述文章,全面概述了该平台的最新进展,系统地探讨了其在生物制造领域的关键优势、最新进展、生物工艺开发和尚存挑战,为指导未来生物医学研究和治疗领域的创新和更广泛应用提供了全面的概述。

(图片来源:Nongyu Huang, et al, J Biol Eng., 2025)
昆虫细胞表达系统在生物医学领域的应用不断拓展
近期一项名为“重组蛋白生产基因表达系统选择简明指南”的调查研究报告指出,昆虫细胞表达系统在易用性、成本效益和速度方面略优于哺乳动物稳定表达平台。除了这些实际优势外,昆虫细胞表达系统还因其安全性而备受推崇:杆状病毒仅感染昆虫细胞,不会在脊椎动物细胞中复制、传播或整合;经济合作与发展组织(OECD)化学品和生物技术委员会在2023年重申了这一点,并得出结论:杆状病毒对人类健康无风险。表1总结了使用该平台生产的已获批准和正在研发的药物。
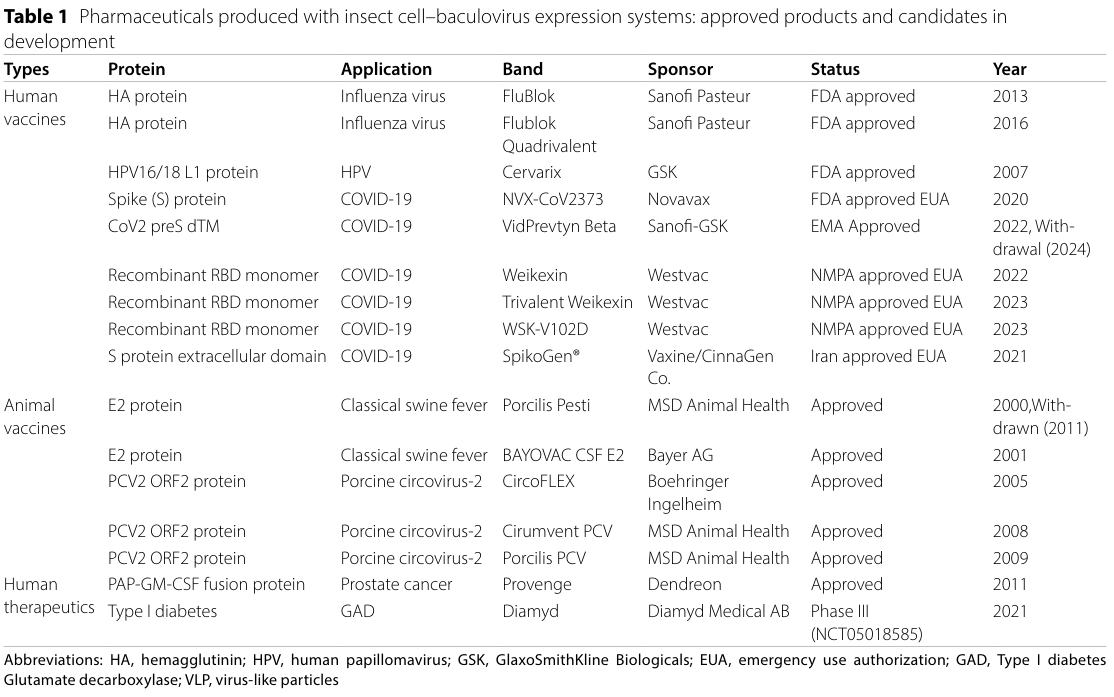
此外,该平台展现出开发针对多种传染病疫苗的巨大潜力。如诺瓦瓦克斯公司开发的呼吸道合胞病毒(RSV)F蛋白纳米颗粒疫苗(III期临床试验,NCT02624947)和埃博拉病毒糖蛋白(EBOV GP)纳米颗粒疫苗(I期临床试验,NCT02370589),武田制药和HilleVax联合开发的二价诺如病毒样颗粒(VLP)疫苗HIL-214(II期临床试验,NCT02669121),神州细胞开发的重组14价人乳头瘤病毒(HPV)VLP疫苗(SCT1000,III期临床试验,NCT06041061)以及康希诺生物开发的一种重组三价脊髓灰质炎病毒VLP疫苗(VLP-Polio,I期临床试验,NCT06101173)等。
动物疫苗生产
昆虫细胞表达系统已成为兽用疫苗研发的领先平台,在真核蛋白加工能力和工业化规模化生产之间实现了最佳平衡。该系统已被应用于针对经典猪瘟病毒(CSFV)的亚单位疫苗和针对猪圆环病毒2型(PCV2)的VLP疫苗的生产,这两种疫苗均已实现商业化应用。
基于VLP的新一代亚单位疫苗具有高免疫原性,且与天然病毒结构高度相似而不含遗传物质,具有优异的安全性,因此备受关注。而昆虫细胞系统能够支持正确的蛋白质折叠和翻译后修饰,非常适合VLP的生产。由瘟病毒A(BVDV-LC)E0和E2蛋白组成的牛病毒性腹泻病毒(BVDV)VLP在昆虫细胞中表达后,能够成功自组装成球形颗粒,并在动物模型中诱导强烈的免疫反应。对于猪δ冠状病毒(PDCoV),昆虫细胞来源的VLP已有效刺激小鼠产生特异性免疫反应。单次接种昆虫细胞生产的低剂量H5N1 VLPs制剂即可诱导产生高滴度的血凝抑制抗体,并赋予其对同源高致病性禽流感病毒(HPAIV)攻击的保护性免疫力。罗氏沼虾结节病毒(MrNV)衣壳蛋白VLPs已被表达、纯化并用于淡水虾,结果显示病毒攻击后存活率显著提高。
治疗性重组蛋白
Provenge(Sipuleucel-T)获得美国食品药品监督管理局(FDA)批准,标志着生物技术在癌症治疗领域应用的一个关键里程碑。研究人员已广泛探索昆虫细胞表达系统作为一种创新的治疗性重组蛋白生产系统,并在重组蛋白表达、规模化生产和工艺开发方面取得了显著进展。
昆虫细胞能够正确折叠抗体分子并引入特定的糖基化修饰,这对于增强抗体的活性和稳定性至关重要。然而,病毒感染造成的瓶颈会显著影响抗体的生产,限制了该平台在抗体表达领域的广泛应用。研究人员仍在不断探索创新解决方案,如利用无杆状病毒的昆虫细胞系统实现了高产量的抗体表达,并利用强效的昆虫细胞启动子构建了瞬时基因表达系统或开发了稳定的转基因细胞系,用于高效生产HIV-1广谱中和抗体b12。此外,家蚕-杆状病毒表达系统已成功生产出针对SARS-CoV-2的CR3022抗体的scFv、Fab和IgG。这些进展表明,昆虫细胞表达系统作为一种生产生物活性单克隆抗体的替代平台具有巨大的潜力。
而在重组蛋白治疗领域,该系统已成功用于生产结构复杂且具有功能活性的蛋白质和VLPs,这些蛋白质和VLPs通常需要二硫键形成或糖基化才能实现正确的折叠和生物功能。代表性例子包括绿丝光菌胶原酶(MMP-1)、蛇毒L-氨基酸氧化酶(SR-LAAO)、Fc融合蛋白和X染色体上的骨髓酪氨酸激酶(BMX)。在治疗性VLP的开发领域,昆虫细胞平台同样展现出巨大的潜力。例如,犬细小病毒-VLPs能够特异性靶向癌细胞上的转铁蛋白受体(TFRs)。此外,在昆虫细胞中产生的具有昆虫型糖基化的HER2靶向VLP在HER2阳性乳腺癌小鼠模型中显示出显著的保护作用。
复杂结构蛋白的基础研究
在蛋白质生产中实现高产量、高纯度和高活性仍然是蛋白质结构、功能和相互作用组分析的一项重大挑战,而昆虫细胞表达系统尤其适用于多种蛋白质的同时表达和多亚基蛋白复合物的高效生产。为了进一步优化这一过程,人们开发了几种先进的杆状病毒载体平台。这些平台包括:HR-bac,利用同源重组高效组装和表达多个基因表达盒;PluriBAC,采用Golden Gate组装技术,能够将四个以上的启动子、目的基因和终止子序列模块化组合,从而实现灵活的多基因表达;以及MoClo-Baculo:这是一种与酵母兼容的替代表达系统,它支持使用模块化克隆(MoClo)策略高效构建多基因表达盒。这些工具能够实现多基因表达和蛋白复合物的高水平生产,从而促进用于结构研究的功能系统的快速构建。
基于昆虫细胞表达系统的平台克服了生产高产活性蛋白的常见挑战。例如,Sousa等人利用5升悬浮培养物,在34天内生产了100毫克纯化的X染色体上的骨髓酪氨酸激酶(BMX),从而实现了BMX抑制剂的高通量筛选。重组醛氧化酶(AOX)是一种复杂的含钼蝶呤的黄素蛋白,传统上难以生产;而基于昆虫细胞表达系统的平台则通过简化的两步法,高效生产和分离了高纯度的重组人AOX二聚体。该方法为肝脏提取物提供了一种可靠的替代方案,确保了药物开发中AOX代谢的准确评估。为了解决尼帕病毒(NiV)感染限制使用野生型病毒进行药物筛选的问题,研究人员开发了一种基于昆虫细胞的平台,该平台表达NiV-F、NiV-G和EphrinB2,以重建NiV诱导的合胞体形成过程。该平台能够筛选具有阻断病毒进入潜力的融合抑制化合物。
除了蛋白质表达之外,在生产细胞内进行重组蛋白的细胞内结晶是一种罕见但极具价值的结构研究策略。研究人员利用杆状病毒克隆系统优化了细胞环境,从而提高了细胞内结晶效率。这些进展展示了昆虫细胞表达系统在使结构生物学能够利用细胞内结晶进行蛋白质结构分析方面的潜力。
总而言之,这些研究结果凸显了昆虫细胞表达系统在生产创新人类疫苗、兽用VLP疫苗、重组蛋白和结构和功能相关蛋白质方面的多功能性和有效性。该系统不仅能够成为下一代疫苗的理想平台,更能促进药物发现、功能蛋白质组学和结构生物学的进步。
新兴技术推动平台创新
昆虫幼虫作为重组蛋白生物生产的可扩展系统
昆虫细胞表达系统不仅限于昆虫细胞培养,还可以利用昆虫幼虫或蛹生产重组蛋白。以昆虫幼虫作为生物反应器具有成本效益高、易于规模化生产重组蛋白的优点。获得监管机构批准的代表性产品包括利用家蚕幼虫开发的Virbagen® Omega,以及利用斜纹夜蛾(Trichoplusia ni)蛹生产的兔出血性疾病病毒(RHDV)疫苗Fatrovax®。近年来,家蚕幼虫生产成本低,促进了其在动物疫苗研发中的广泛应用,包括针对猪圆环病毒2型(PCV2)、猪轮状病毒A、猪流行性腹泻病毒和禽流感病毒的疫苗。
rAAV制造
重组腺相关病毒(rAAV)因其体内稳定性好、毒性低而被广泛应用于基因治疗,哺乳动物细胞(例如HEK293)和昆虫细胞(例如Sf9)是主要的生产平台。尽管功能相似,但与基于HEK293的方法相比,昆虫细胞表达系统通常具有更高的产量、更优的满空衣壳比、更低的残留宿主DNA以及更强的可扩展性(表2)。该系统在rAAV生产中的应用比例从2007年之前的约5.6%上升到2022年的20%以上。截至2025年4月,共有9种重组腺相关病毒(rAAV)基因治疗产品获得监管部门批准。其中,Glybera、Hemgenix 和Roctavian均采用昆虫细胞表达系统进行生产,凸显了该平台在rAAV生产方面的工业可行性和监管认可度。

(表格来源:Nongyu Huang, et al, J Biol Eng., 2025)
基因转移和治疗
杆状病毒本身具有作为多功能基因转移载体的巨大潜力,这得益于其庞大的基因有效载荷能力以及无法复制或整合到哺乳动物基因组中的特性。基于杆状病毒的病毒载体疫苗,例如FrC-OVA-BV,已证实可通过表达破伤风毒素C片段(FrC)和卵清蛋白(OVA)肽段显著激活CD8+ T细胞介导的免疫反应,并在EG7-OVA肿瘤小鼠模型中展现出强大的抗肿瘤活性。与野生型杆状病毒相比,展示人内源性逆转录病毒(HERV)包膜的工程化杆状病毒载体在人细胞中的基因转移效率显著提高。基于此平台的重组疫苗能够诱导强烈的体液和细胞免疫反应,并在动物模型中提供完全保护。此外,杆状病毒还通过在包膜上表达衰变加速因子(DAF,CD55)、递送基因编辑工具、与磁性纳米颗粒结合等多种应用方式,证明其在基因传递和基于病毒载体的疫苗开发中的潜在作用,为这些领域的进步做出了重大贡献。
充分发挥昆虫细胞表达系统平台潜力的策略
揭示新的机制
杆状病毒感染过程中昆虫细胞的变异仍然是病毒学中最难理解的现象之一。二代测序(NGS)和生物信息学的进步极大地推动了昆虫细胞表达系统响应的研究,为合理设计和工艺工程策略提供了关键见解。例如,Bruder等人利用转录组数据鉴定了一系列具有不同表达特征的天然AcMNPV启动子(例如polh、p6.9、vp39和39k),随后使用GFP和SEAP表达模型验证。这项研究首次应用生物信息学分析来识别影响后期基因转录和翻译效率的关键启动子序列特征。这些发现不仅扩展了杆状病毒启动子的目录,而且实现了外源基因在多顺反子结构中的精确共表达。而单细胞RNA测序(scRNA-seq)的应用使研究人员能够解析病毒感染动力学并识别与高效蛋白生产相关的细胞亚群。此外,研究人员还整合了NGS和计算模拟,开发了一种新型定向进化方案。经该方案优化的衣壳不仅表现出更高的产量,而且具有更优异的转导效率。总之,组学指导的研究显著增进了我们对昆虫细胞表达系统中细胞反应的理解。
基因工程方法
为了提高重组蛋白的产量,需要对昆虫细胞表达系统进行病毒基因组工程改造。CRISPR-Cas9技术的最新进展为克服系统瓶颈提供了创新解决方案。Pazmiño等人首次证明了CRISPR-Cas9可用于AcMNPV基因敲除。在此基础上,Bruder等人构建了稳定表达Cas9的昆虫细胞系,使用经过改造的杆状病毒感染这些细胞系可将出芽病毒的产量降低到野生型水平的10%以下。后续研究进一步拓展了CRISPR的应用,包括在gp64中引入插入/缺失突变或同时靶向gp64和vp80,从而显著降低了杆状病毒的释放并提高了VLP的产量。与此同时,非CRISPR策略也为系统改进做出了贡献,例如缩短同源区域和引入点突变以减少重组可以提高载体稳定性。此外,利用λ噬菌体Red重组系统性地删除非必需的AcMNPV基因已被证明可以提高重组蛋白产量。
基因组工程在宿主昆虫细胞改造中也发挥着至关重要的作用,能够进一步提高昆虫细胞表达系统的性能。CRISPR-Cas9位点特异性基因组编辑工具已被用于修饰杆状病毒-昆虫细胞系统中的蛋白质糖基化模式,可以实现优化杆状病毒的生产环境,或消除Sf9细胞中的凋亡特征。在另一项研究中,将靶向caspase-1保守区域的短发夹RNA(shRNA)插入到删除了非必需基因的杆状病毒载体中,有效抑制了Sf9和High Five细胞的凋亡,从而提高了蛋白质表达效率,并拓宽了在研究和制药行业的应用。
表达载体的创新
目前,Bac-to-Bac系统广泛用于稳定的单基因表达,而FlashBAC系统则通过加速表达过程来提高效率。MultiBac系统专为多基因表达而设计,pTri和pQE-Tri系统均兼容原核细胞、昆虫细胞和哺乳动物细胞,能够满足多样化的表达需求。载体系统的不断优化正推动着表达技术的持续进步。
载体系统改造的最新进展包括:利用pIEx/BacMagic 3表达载体系统和Gateway克隆技术,开发了一种基于昆虫细胞表达系统的蛋白质生产流程,实现了重组蛋白的大规模并行表达和体内微晶的快速筛选。为了增强启动子活性,研究人员开发了一种改造后的表达载体,该载体整合了凡纳滨对虾阴阳1(Lv YY1)基因,该基因被鉴定为ie1启动子的功能性增强子。Lv YY1的存在显著促进了转录激活,从而提高了表达抗原的产量。为了提高生物安全性和蛋白质产量,研究人员开发了一种lef5缺陷型杆状病毒表达系统,以抑制后期基因表达并阻止杆状病毒颗粒的形成。与传统系统相比,该方法将蛋白质分泌效率提高了1.8倍,延长了感染持续时间,并优化了细胞培养条件。此外,利用工程化的杆状病毒穿梭载体,可以生成具有新功能的从头设计的蛋白质(例如含有非典型氨基酸的重组蛋白质),该载体递送正交的吡咯赖氨酰-tRNA/氨酰基-。
tRNA合成酶对(tRNA^Pyl/PylRS)系统能够构建具有新颖化学性质的氨基酸衍生物库,用于位点特异性地掺入靶蛋白中。Bac-to-Bac系统中的遗传密码扩展策略拓展了重组蛋白工程的可能性,为利用非天然氨基酸开发具有新功能的蛋白质铺平了道路。为了促进柞蚕多衣壳核型多角体病毒(AnpeNPV)蛹中重组蛋白的生产,研究人员开发了AnpeNPV表达载体,构建了线性衍生物AnpeNPVPhEGFP-AvrII。该方法显著提高了重组效率,并降低了非重组子代的比例。利用转化相关重组(TAR)技术,研究人员成功合成了AcMNPV的完整基因组,并在昆虫细胞中拯救了重组病毒,同时保留了其天然的生物学特性。在此基础上,研究人员构建了一种新型杆状病毒载体AcBac-Syn,实现了外源基因的高效表达,为重组蛋白生产和基因表达系统开发提供了一种强有力的工具。
这些进展表明昆虫细胞表达系统在疫苗开发、病毒组装研究和蛋白质工程方面具有巨大的潜力,使其成为下一代病毒疫苗和治疗性蛋白质生产的强大工具。
生产过程的建立和优化
昆虫细胞表达系统仍存在一些局限性,例如在某些情况下表达量相对较低,以及下游加工方面的挑战,特别是残留杆状病毒和宿主细胞杂质的去除。鉴于这些优势和挑战,了解昆虫细胞表达系统的核心工作流程至关重要,该流程包括杆状病毒的生产、昆虫细胞感染和蛋白质纯化(图1)。
图1:昆虫细胞表达系统生产流程及其面临的挑战总结
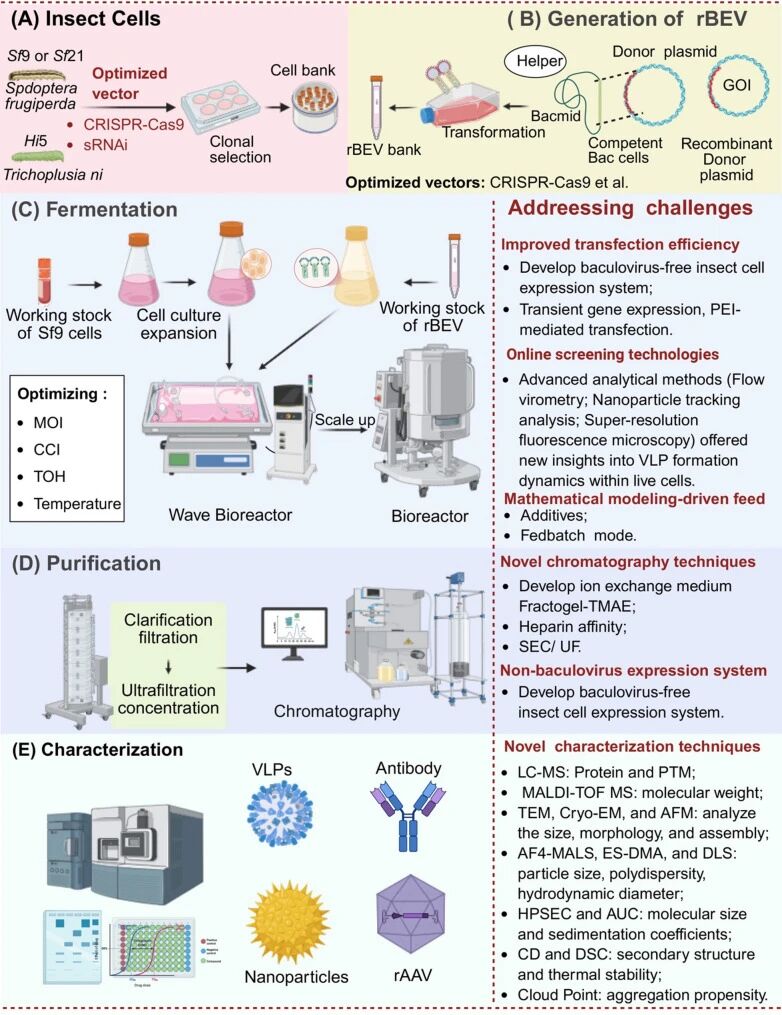
(图片来源:Nongyu Huang, et al, J Biol Eng., 2025)
同时,利用聚乙烯亚胺(PEI)介导的转染进行瞬时基因表达(TGE)已证明其在High Five细胞生物反应器中生产VLP具有可扩展性,与传统的摇瓶培养相比,产量提高了1.8倍。为了克服杆状病毒系统的局限性,Puente-Massaguer等人开发了一种非杆状病毒TGE系统,该系统采用pIZTV5载体和PEI介导的转染,实现了在昆虫细胞中快速生产VLP。
由于杆状病毒颗粒与病毒颗粒具有相似的理化性质,因此在VLP生产过程中,杆状病毒颗粒的共表达会使纯化变得复杂。为了应对这一挑战,Puente-Massaguer等人系统地评估了感染时细胞浓度(CCI)、感染复数(MOI)和收获时间(TOH)之间的相互作用,为生产给出了指导意见。此外,超分辨率荧光显微镜为活细胞内VLP的形成动力学提供了新的见解。包括共聚焦显微镜、流式显微镜和纳米颗粒追踪分析在内的先进分析方法,使得VLP生产工艺的全面优化成为可能。
优化要点2:收获和提纯过程
鉴于病毒污染的重大风险,监管机构要求进行病毒清除研究,以评估纯化过程消除内源性和外源性病毒的能力,从而确保产品安全。昆虫细胞表达的VLP的下游加工在技术上具有挑战性,需要高效的色谱策略。其中,离子交换色谱(IEC)常用于捕获和浓缩VLP。另一种广泛应用的方法是亲和色谱(AC),它在VLP和病毒纯化方面具有很高的特异性。然而,在初步捕获步骤之后,通常还需要额外的精制步骤。尺寸排阻色谱法(SEC)和超滤/渗滤(UF/DF)等技术常用于提高产品的纯度和质量。
除了优化下游纯化工艺外,研究人员还探索了减少杆状病毒污染的上游策略。值得注意的是,van Oosten等人通过在表达载体中构建热敏开关,开发了一种用于杆状病毒生产的温度依赖性控制系统。该方法能够严格调控杆状病毒的复制,从而最大限度地减少VLP生产过程中杆状病毒颗粒的污染,并简化下游工艺。
为确保基于昆虫细胞表达系统的病毒安全性,通常采用多种互补的分析方法来监测和降低潜在风险。二代测序(NGS)可在基因组水平上对内源性病毒元件和外源性病原体进行全面筛查,正逐渐被用作替代动物实验方法的手段。同时,定量PCR(qPCR)可高灵敏度地检测特定病毒序列,逆转录酶(RT)检测用于评估逆转录病毒活性,透射电子显微镜(TEM)可直接观察细胞内的病毒颗粒。这些方法共同构建了一个稳健的安全框架,支持监管合规性并确保昆虫细胞衍生生物制药的可靠性。
总结
当前昆虫细胞表达系统仍然是生物制造的基石,其无与伦比的可扩展性和多功能性使其成为应对复杂疫苗研发挑战的不可或缺的工具。该系统的关键优势在于其卓越的灵活性,能够精确设计载体,从而实现目标蛋白表达所需的尺寸、结构呈现和寡聚构型;且通常认为与昆虫细胞相关的病毒安全风险较低,可通过适当的病毒检测和清除策略进行控制。随着昆虫细胞平台在生物制剂开发中的应用日益广泛,预计这些系统的特性及其相关的监管框架都将日趋成熟。单细胞测序、基因编辑、合成生物学和人工智能(AI)的最新突破也将为克服现有昆虫细胞表达系统的局限性提供新的途径。
参考文献:
https://jbioleng.biomedcentral.com/articles/10.1186/s13036-025-00562-4#Sec16

地址:中国武汉东湖高新区光谷七路128号 市场:17720522078 人事行政:027-62439686 邮箱:marketing@genevoyager.com
BD 商务总台:17720514121 /13886000399(BD 经理) /17720515371(BD 经理)
本公司所有产品仅供实验科研使用,不用于人体疾病治疗及临床诊断。